AASLD2018研究进展丨慢乙肝患者治疗期间的肾脏安全管理
2019-06-14 14:22
阅读:12480
来源:国际肝病网
作者:点*管
责任编辑:IIYI编辑部
[导读]在新药取得成功之前,应用口服核苷(酸)类似物(NA)治疗慢性乙型肝炎(简称慢乙肝)需要长期用药。当前推荐的一线NA都能有效长期抑制病毒,在这个前提下,人们越来越关注长期用药的安全问题,希望能给患者更好的疾病管理。从AASLD2018上的最新数据中,我们可以获得哪些启示呢?
年龄和合并症增加成为慢乙肝管理必须重视的问题
一个摆在大家面前的客观事实是,慢乙肝患者在慢慢变老。如韩国汉阳大学医学院学者DaewooJun等在会上报告(摘要号2150)[1],根据对韩国健康保险审查和评估机构数据库中符合标准的253,002名成人慢乙肝病例的数据分析,2007年慢乙肝患者的平均年龄为47岁,2016年增加为52岁,65岁以上人群所占比例从10.4%增加为15.7%。
伴随年龄增加的是,CHB患者的合并症也在增加。2016年,韩国慢乙肝患者中37%合并高脂血症、29%合并高血压、21%合并骨关节炎、20%合并糖尿病、9%合并骨质疏松/骨折、4.8%合并脑血管疾病、2.3%合并慢性肾病,以上数据均较2007年有显著增加(图1;结果参考自AASLD2018年会现场展出壁报)。患者年龄老化和合并症增加均可能影响慢乙肝的管理,临床应加以重视。
肾脏安全是NA选择的重要考量因素
肾脏是机体重要的排泄器官,肾脏安全是选择NA的重要考量因素,特别是对于已经有肾功能损害或是有肾损害危险因素的患者。这是因为乙肝常用药物如恩替卡韦(ETV)和替诺福韦二吡呋酯(TDF)等都主要或全部以原型从肾脏排泄,可通过不同机制导致肾脏损伤[2]。另一方面,衰老可导致肾功能下降,高血压、糖尿病等疾病会对肾脏造成损害,患者的这些基线特征,也可能影响药物潜在肾脏毒性的发生或严重程度。
TDF
一些研究报道,在TDF用药期间有少量病例出现慢性肾小管损伤、eGFR下降和骨矿物质密度下降。另外,有TDF治疗期间肾功能损害加重,甚至发生范可尼综合征的病例报道[3]。尽管上述不良事件的发生率很低,EASL指南仍然建议,对于TDF治疗的所有病例,基线时均应对肾功能进行评估。
ETV
TDF和ETV长期治疗期间少量患者可出现肾功能下降。AASLD指南[4]指出,现有证据并不说明TDF或ETV治疗的乙肝患者在肾功能不全、低磷血症或骨矿物密度方面有显著差异。
AASLD2018上,来自韩国汉阳大学医学院JaeYoonJeong等报告的一项多中心、回顾性队列真实世界研究[5](摘要号2090)也显示,ETV和TDF治疗2年后的患者肾脏功能无区别。该研究共纳入了1349例初治慢乙肝患者,分别使用ETV(531例)或TDF(818例)治疗。治疗2年后,ETV治疗组和TDF治疗组的肌酐变化水平差异无统计学意义(-0.1vs.0.09mg/dL,P=0.07),eGFR水平变化差异也无统计学意义(P=0.24和0.14,使用不同计算方法)。多因素分析显示,与eGFR水平下降>25%有关的***预测因素有基线白蛋白水平、ALT水平、年龄和应用非甾体抗炎药。
富马酸丙酚替诺福韦(TAF)
TAF是乙肝一线治疗用药队伍中的新成员。它最大的优势或许可称为“靶向肝脏”。TAF的体外血浆半衰期达90min,显著长于TDF的0.4min,在血浆中更稳定。1b期研究发现,≤25mg的TAF能达到与300mg的TDF相似的病毒抑制,但TFV的暴露减少90%以上[6]。对机制的进一步研究[7]显示,TAF能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取TAF,摄取率约65%[8]。TAF在肝脏中的高效摄取与肝细胞表达的阴离子转运多肽(OATP1B1和OATP1B3)有关,活化主要由羧酸酯酶1介导[7]。所以,TAF能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、全身暴露减少,从而肾脏和骨骼毒性下降[4]。
TAF对比TDF治疗慢乙肝的III期临床试验早期48周[9,10]和96周[11,12]的结果均显示,TAF治疗期间的肾脏安全数据和骨骼代谢数据都比TDF更好,并且TDF治疗的患者换用TAF后,可观察到如蛋白尿、白蛋白尿、近端肾小管功能和BMD等肾脏和骨骼的安全性指标改善[13]。
AASLD2018上公布了研究的144周数据(摘要号381)[14]。TDF治疗3年,肌酐清除率下降的中位数为6.0mL/min,显著高于TAF治疗(1.2mL/min);TAF治疗组的eGFRCG仅有轻微下降(图2)。同样,治疗3年时,TDF组脊柱和髋关节的BMD下降更加明显(图3)。这提示TAF与TDF相比,持续表现出肾脏和骨骼安全性的改善。
来自新西兰的EdwardGane教授团队报告(摘要号1225)[15],合并CKD2级或以上肾病的51例肝移植术后患者按1∶1随机分组,接受换用TAF或继续TDF治疗48周。所有患者均取得病毒学应答。TAF组的严重不良事件发生率低于TDF组(12%vs.28%),无患者停药(TDF组有1例患者因不良事件停药)。48周治疗期间,TAF组患者的eGFRCKD-EPI增加高于TDF组(3.9vs0.2mL/min/1.73m2),图4。TAF治疗组的脊柱和髋关节骨密度增加,而TDF组下降(图5)。
而且在基线有严重肾功能不全风险因素的患者中,TDF治疗和TAF治疗的eGFR变化差异和BMD变化差异更加显著。这说明在这个人群中,换用TAF治疗较继续使用TDF治疗可获得肾脏和骨骼安全数据的改善。TAF在这一高危人群中安全、耐受性好,有效。
对肾功能不全人群应用NA的推荐意见
对于NA治疗时肾功能的监测和患者肾功能安全的管理,欧美指南做出了相应推荐,临床医生也可参照药品说明书执行。主要包括:
关于患者监测和评估
所有患者治疗前均应评估肾脏风险。
有肾病风险的患者不管使用何种NA治疗,或使用TDF治疗的所有患者,都应定期接受肾功能监测,包括至少一次eGFR检测和血磷水平检测。
关于药物选择和换药
AASLD指南[4]建议,就潜在的长期肾脏和骨骼并发症风险而言,在ETV或TDF间没有偏好。TAF与TDF相比,与更低的骨骼和肾脏异常率有关。
根据EASL指南[3],60岁以上,或有骨骼疾病(长期使用激素或其他有损骨密度的药物,有脆性骨折史,骨质疏松),或有肾功能异常(eGFR<60min/mL/1.73m2,白蛋白尿>30mg或中等量蛋白尿,低磷,血透),提示应选择TAF或ETV,而不是TDF。既往有核苷类药物(即拉米夫定、替比夫定)暴露的患者应优先考虑TAF。
AASLD指南[4]中指出,如果怀疑TDF相关肾功能不全和/或骨病,应停用TDF,根据任何已知的耐药情况换用TAF或ETV。EASL指南[3]中也有类似表述:有发生肾功能损害或骨病风险或有肾脏或骨骼基础疾病的患者,应根据之前拉米夫定暴露情况,考虑换用TAF或ETV。如果已经应用TDF治疗,从更安全长期治疗的角度讲,可以考虑换用TAF。
关于剂量调整
ETV和TDF在肾功能不全(eGFR<50mL/min)的患者中,需要调整剂量。在eGFR<30以及血透人群中,ETV的应用数据很少。TAF在年龄>65岁、肝功能损伤、肾功能损伤人群中(包括eGFR≥15mL/min或eGFR<15mL/min的血透患者),均无需调整剂量[16]。
总结
NA应用于慢乙肝的治疗已经超过二十年,慢乙肝的管理实践也在一点点优化和一步步拔高中,向着“更好”的方向前行。在NA长期治疗过程中,我们不应满足“整体安全性很好”的现状,而是应该努力优化诊疗方案,给予患者更好的保护。肾脏和骨骼安全是慢乙肝患者长期治疗中的潜在隐患,临床医生需加强对这一问题的认识,更全面地思考和评估患者,给予他们更安全有效的管理方案。
参考文献
1.JunDW,OhHW,AhnHJ,etal.IncreasingAgeandComorbiditiesinaPopulation-BasedStudyofChronicHepatitisB(CHB)Patientsfrom2007to2016inKorea.AASLD2018.Poster2150
2.ButiM,Riveiro-BarcielaM,EstebanR.Long-termsafetyandefficacyofnucleo(t)side**oguetherapyinhepatitisB.LiverInternational.2018;38(Suppl.1):84–89.
3.EuropeanAssociationfortheStudyoftheLiver.EASL2017ClinicalPracticeGuidelinesonthemanagementofhepatitisBvirusinfection.JHepatol(2017),http://dx.doi.org/10.1016/j.jhep.2017.03.021
4.TerraultNA,LokAS,McMahonBJ,etal.UpdateonPrevention,Diagnosis,andTreatmentandofChronicHepatitisB:AASLD2018HepatitisBGuidance.Hepatology.2018,https://doi.org/10.1002/hep.29800
5.JeongJY,JunDW,SohnJH,etal.RenalSafetyofEntecavirandTenofovirinPatientswithTreatment-Nai?NveChronicHepatitisBVirusInfectioninRealLifeSetting:AMulticenter,RetrospectiveCohortStudy.AASDL2018,Poster2090.
6.AgarwalK,FungSK,NguyenTT,etal.Twenty-eightdaysafety,antiviralactivity,andpharmacokineticsoftenofoviralafenamidefortreatmentofchronichepatitisBinfection.JHepatol2014;62:533–540..
7.MurakamiE,WangT,ParkYJ,etal.ImplicationsofEfficientHepaticDeliverybyTenofovirAlafenamide(GS-7340)forHepatitisBVirusTherapy.AntimicrobAgentsChemoth.2015;59(6):3563-3569
8.BabusisD,PhanTK,LeeWA,etal.MechanismforeffectivelymphoidcellandtissueloadingfollowingoraladministrationofnucleotideprodrugGS-7340.MolPharm2013.10:459–466.
9.ButiM,GaneEd,SetoWK,etal.TenofoviralafenamideversustenofovirdisoproxilfumarateforthetreatmentofpatientswithHBeAg-negativechronichepatitisBvirusinfection:arandomised,double-blind,phase3,non-inferioritytrial.LancetGastroenterolHepatol.2016;1:196–206.
10.ChanHL,Fung,SetoWK,etal.TenofoviralafenamideversustenofovirdisoproxilfumarateforthetreatmentofHBeAg-positivechronichepatitisBvirusinfection:arandomised,double-blind,phase3,non-inferioritytrial.LancetGastroenterolHepatol.2016;1:185–95.
11.AgarwalK,FungS,SetoWK,etal.Aphase3studycomparingtenofoviralafenamide(TAF)totenofovirdisoproxilfumarate(TDF)inpatientswithHBeAg-positive,chronichepatitisB:efficacyandsafetyresultsatweek96JHepatol.2017;66(suppl1):S478.FIR-153
12.BrunettoM,LimYS,GaneE,SetoWK,OsipenkoM,AhnSH,JanssenHS,etal.APhase3StudyComparingTenofovirAlafenamide(TAF)toTenofovirDisoproxilFumarate(TDF)inPatientsWithHBeAg-Negative,ChronicHepatitisB(CHB):EfficacyandSafetyResultsatWeek96.JHepatol2017;152(suppl1):S25.PS-042
13.VoTL,NishiguchiS,KimHJ,etal.Oneyearafterswitchingfromtenofovirdisoproxilfumarate(TDF)totenofoviralafenamide(TAF):safetyresultsfrom2phase3studiesinHBeAg-positiveandHBeAg-negativepatientswithchronichepatitisB(CHB).APASL2018.O-HBV-13.
14.ChanHL,LimYS,SetoWK,etal.ThreeYearEfficacyandSafetyofTenofovirAlafenamide(TAF)ComparedtoTenofovirDisoproxilFumarate(TDF)inHbeag-NegativeandHbeag-PositivePatientswithChronicHepatitisB.AASLD2018Poster381.
15.GaneEJ,GeorgeB,Ray-ChaudhuriD,etal.SafetyandEfficacyat1YearinPostLiverTransplantPatientswithChronicKidneyDiseaseReceivingTenofovirAlafenamideforHBVProphylaxis.AASLD2018.Poster1225
一个摆在大家面前的客观事实是,慢乙肝患者在慢慢变老。如韩国汉阳大学医学院学者DaewooJun等在会上报告(摘要号2150)[1],根据对韩国健康保险审查和评估机构数据库中符合标准的253,002名成人慢乙肝病例的数据分析,2007年慢乙肝患者的平均年龄为47岁,2016年增加为52岁,65岁以上人群所占比例从10.4%增加为15.7%。
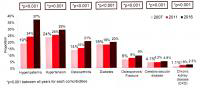
伴随年龄增加的是,CHB患者的合并症也在增加。2016年,韩国慢乙肝患者中37%合并高脂血症、29%合并高血压、21%合并骨关节炎、20%合并糖尿病、9%合并骨质疏松/骨折、4.8%合并脑血管疾病、2.3%合并慢性肾病,以上数据均较2007年有显著增加(图1;结果参考自AASLD2018年会现场展出壁报)。患者年龄老化和合并症增加均可能影响慢乙肝的管理,临床应加以重视。
图1.慢乙肝患者中并存疾病的患病比例
肾脏安全是NA选择的重要考量因素
肾脏是机体重要的排泄器官,肾脏安全是选择NA的重要考量因素,特别是对于已经有肾功能损害或是有肾损害危险因素的患者。这是因为乙肝常用药物如恩替卡韦(ETV)和替诺福韦二吡呋酯(TDF)等都主要或全部以原型从肾脏排泄,可通过不同机制导致肾脏损伤[2]。另一方面,衰老可导致肾功能下降,高血压、糖尿病等疾病会对肾脏造成损害,患者的这些基线特征,也可能影响药物潜在肾脏毒性的发生或严重程度。
TDF
一些研究报道,在TDF用药期间有少量病例出现慢性肾小管损伤、eGFR下降和骨矿物质密度下降。另外,有TDF治疗期间肾功能损害加重,甚至发生范可尼综合征的病例报道[3]。尽管上述不良事件的发生率很低,EASL指南仍然建议,对于TDF治疗的所有病例,基线时均应对肾功能进行评估。
ETV
TDF和ETV长期治疗期间少量患者可出现肾功能下降。AASLD指南[4]指出,现有证据并不说明TDF或ETV治疗的乙肝患者在肾功能不全、低磷血症或骨矿物密度方面有显著差异。
AASLD2018上,来自韩国汉阳大学医学院JaeYoonJeong等报告的一项多中心、回顾性队列真实世界研究[5](摘要号2090)也显示,ETV和TDF治疗2年后的患者肾脏功能无区别。该研究共纳入了1349例初治慢乙肝患者,分别使用ETV(531例)或TDF(818例)治疗。治疗2年后,ETV治疗组和TDF治疗组的肌酐变化水平差异无统计学意义(-0.1vs.0.09mg/dL,P=0.07),eGFR水平变化差异也无统计学意义(P=0.24和0.14,使用不同计算方法)。多因素分析显示,与eGFR水平下降>25%有关的***预测因素有基线白蛋白水平、ALT水平、年龄和应用非甾体抗炎药。
富马酸丙酚替诺福韦(TAF)
TAF是乙肝一线治疗用药队伍中的新成员。它最大的优势或许可称为“靶向肝脏”。TAF的体外血浆半衰期达90min,显著长于TDF的0.4min,在血浆中更稳定。1b期研究发现,≤25mg的TAF能达到与300mg的TDF相似的病毒抑制,但TFV的暴露减少90%以上[6]。对机制的进一步研究[7]显示,TAF能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取TAF,摄取率约65%[8]。TAF在肝脏中的高效摄取与肝细胞表达的阴离子转运多肽(OATP1B1和OATP1B3)有关,活化主要由羧酸酯酶1介导[7]。所以,TAF能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、全身暴露减少,从而肾脏和骨骼毒性下降[4]。
TAF对比TDF治疗慢乙肝的III期临床试验早期48周[9,10]和96周[11,12]的结果均显示,TAF治疗期间的肾脏安全数据和骨骼代谢数据都比TDF更好,并且TDF治疗的患者换用TAF后,可观察到如蛋白尿、白蛋白尿、近端肾小管功能和BMD等肾脏和骨骼的安全性指标改善[13]。
AASLD2018上公布了研究的144周数据(摘要号381)[14]。TDF治疗3年,肌酐清除率下降的中位数为6.0mL/min,显著高于TAF治疗(1.2mL/min);TAF治疗组的eGFRCG仅有轻微下降(图2)。同样,治疗3年时,TDF组脊柱和髋关节的BMD下降更加明显(图3)。这提示TAF与TDF相比,持续表现出肾脏和骨骼安全性的改善。
图2.富马酸丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝全球III期研究144周的eGFR变化
图3.富马酸丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝全球III期研究144周的骨密度变化
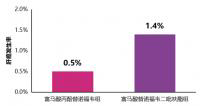
来自新西兰的EdwardGane教授团队报告(摘要号1225)[15],合并CKD2级或以上肾病的51例肝移植术后患者按1∶1随机分组,接受换用TAF或继续TDF治疗48周。所有患者均取得病毒学应答。TAF组的严重不良事件发生率低于TDF组(12%vs.28%),无患者停药(TDF组有1例患者因不良事件停药)。48周治疗期间,TAF组患者的eGFRCKD-EPI增加高于TDF组(3.9vs0.2mL/min/1.73m2),图4。TAF治疗组的脊柱和髋关节骨密度增加,而TDF组下降(图5)。
图4.肝移植术后患者换用富马酸丙酚替诺福韦和继续使用替诺福韦二吡呋酯治疗1年的肾功能变化
图5.肝移植术后患者换用富马酸丙酚替诺福韦和继续使用替诺福韦二吡呋酯治疗1年的骨密度变化
而且在基线有严重肾功能不全风险因素的患者中,TDF治疗和TAF治疗的eGFR变化差异和BMD变化差异更加显著。这说明在这个人群中,换用TAF治疗较继续使用TDF治疗可获得肾脏和骨骼安全数据的改善。TAF在这一高危人群中安全、耐受性好,有效。
对肾功能不全人群应用NA的推荐意见
对于NA治疗时肾功能的监测和患者肾功能安全的管理,欧美指南做出了相应推荐,临床医生也可参照药品说明书执行。主要包括:
关于患者监测和评估
所有患者治疗前均应评估肾脏风险。
有肾病风险的患者不管使用何种NA治疗,或使用TDF治疗的所有患者,都应定期接受肾功能监测,包括至少一次eGFR检测和血磷水平检测。
关于药物选择和换药
AASLD指南[4]建议,就潜在的长期肾脏和骨骼并发症风险而言,在ETV或TDF间没有偏好。TAF与TDF相比,与更低的骨骼和肾脏异常率有关。
根据EASL指南[3],60岁以上,或有骨骼疾病(长期使用激素或其他有损骨密度的药物,有脆性骨折史,骨质疏松),或有肾功能异常(eGFR<60min/mL/1.73m2,白蛋白尿>30mg或中等量蛋白尿,低磷,血透),提示应选择TAF或ETV,而不是TDF。既往有核苷类药物(即拉米夫定、替比夫定)暴露的患者应优先考虑TAF。
AASLD指南[4]中指出,如果怀疑TDF相关肾功能不全和/或骨病,应停用TDF,根据任何已知的耐药情况换用TAF或ETV。EASL指南[3]中也有类似表述:有发生肾功能损害或骨病风险或有肾脏或骨骼基础疾病的患者,应根据之前拉米夫定暴露情况,考虑换用TAF或ETV。如果已经应用TDF治疗,从更安全长期治疗的角度讲,可以考虑换用TAF。
关于剂量调整
ETV和TDF在肾功能不全(eGFR<50mL/min)的患者中,需要调整剂量。在eGFR<30以及血透人群中,ETV的应用数据很少。TAF在年龄>65岁、肝功能损伤、肾功能损伤人群中(包括eGFR≥15mL/min或eGFR<15mL/min的血透患者),均无需调整剂量[16]。
总结
NA应用于慢乙肝的治疗已经超过二十年,慢乙肝的管理实践也在一点点优化和一步步拔高中,向着“更好”的方向前行。在NA长期治疗过程中,我们不应满足“整体安全性很好”的现状,而是应该努力优化诊疗方案,给予患者更好的保护。肾脏和骨骼安全是慢乙肝患者长期治疗中的潜在隐患,临床医生需加强对这一问题的认识,更全面地思考和评估患者,给予他们更安全有效的管理方案。
参考文献
1.JunDW,OhHW,AhnHJ,etal.IncreasingAgeandComorbiditiesinaPopulation-BasedStudyofChronicHepatitisB(CHB)Patientsfrom2007to2016inKorea.AASLD2018.Poster2150
2.ButiM,Riveiro-BarcielaM,EstebanR.Long-termsafetyandefficacyofnucleo(t)side**oguetherapyinhepatitisB.LiverInternational.2018;38(Suppl.1):84–89.
3.EuropeanAssociationfortheStudyoftheLiver.EASL2017ClinicalPracticeGuidelinesonthemanagementofhepatitisBvirusinfection.JHepatol(2017),http://dx.doi.org/10.1016/j.jhep.2017.03.021
4.TerraultNA,LokAS,McMahonBJ,etal.UpdateonPrevention,Diagnosis,andTreatmentandofChronicHepatitisB:AASLD2018HepatitisBGuidance.Hepatology.2018,https://doi.org/10.1002/hep.29800
5.JeongJY,JunDW,SohnJH,etal.RenalSafetyofEntecavirandTenofovirinPatientswithTreatment-Nai?NveChronicHepatitisBVirusInfectioninRealLifeSetting:AMulticenter,RetrospectiveCohortStudy.AASDL2018,Poster2090.
6.AgarwalK,FungSK,NguyenTT,etal.Twenty-eightdaysafety,antiviralactivity,andpharmacokineticsoftenofoviralafenamidefortreatmentofchronichepatitisBinfection.JHepatol2014;62:533–540..
7.MurakamiE,WangT,ParkYJ,etal.ImplicationsofEfficientHepaticDeliverybyTenofovirAlafenamide(GS-7340)forHepatitisBVirusTherapy.AntimicrobAgentsChemoth.2015;59(6):3563-3569
8.BabusisD,PhanTK,LeeWA,etal.MechanismforeffectivelymphoidcellandtissueloadingfollowingoraladministrationofnucleotideprodrugGS-7340.MolPharm2013.10:459–466.
9.ButiM,GaneEd,SetoWK,etal.TenofoviralafenamideversustenofovirdisoproxilfumarateforthetreatmentofpatientswithHBeAg-negativechronichepatitisBvirusinfection:arandomised,double-blind,phase3,non-inferioritytrial.LancetGastroenterolHepatol.2016;1:196–206.
10.ChanHL,Fung,SetoWK,etal.TenofoviralafenamideversustenofovirdisoproxilfumarateforthetreatmentofHBeAg-positivechronichepatitisBvirusinfection:arandomised,double-blind,phase3,non-inferioritytrial.LancetGastroenterolHepatol.2016;1:185–95.
11.AgarwalK,FungS,SetoWK,etal.Aphase3studycomparingtenofoviralafenamide(TAF)totenofovirdisoproxilfumarate(TDF)inpatientswithHBeAg-positive,chronichepatitisB:efficacyandsafetyresultsatweek96JHepatol.2017;66(suppl1):S478.FIR-153
12.BrunettoM,LimYS,GaneE,SetoWK,OsipenkoM,AhnSH,JanssenHS,etal.APhase3StudyComparingTenofovirAlafenamide(TAF)toTenofovirDisoproxilFumarate(TDF)inPatientsWithHBeAg-Negative,ChronicHepatitisB(CHB):EfficacyandSafetyResultsatWeek96.JHepatol2017;152(suppl1):S25.PS-042
13.VoTL,NishiguchiS,KimHJ,etal.Oneyearafterswitchingfromtenofovirdisoproxilfumarate(TDF)totenofoviralafenamide(TAF):safetyresultsfrom2phase3studiesinHBeAg-positiveandHBeAg-negativepatientswithchronichepatitisB(CHB).APASL2018.O-HBV-13.
14.ChanHL,LimYS,SetoWK,etal.ThreeYearEfficacyandSafetyofTenofovirAlafenamide(TAF)ComparedtoTenofovirDisoproxilFumarate(TDF)inHbeag-NegativeandHbeag-PositivePatientswithChronicHepatitisB.AASLD2018Poster381.
15.GaneEJ,GeorgeB,Ray-ChaudhuriD,etal.SafetyandEfficacyat1YearinPostLiverTransplantPatientswithChronicKidneyDiseaseReceivingTenofovirAlafenamideforHBVProphylaxis.AASLD2018.Poster1225
版权声明:
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
AASLD2018研究进展丨慢乙肝患者治疗期间的肾脏安全管理
在新药取得成功之前,应用口服核苷(酸)类似物(NA)治疗慢性乙型肝炎(简称...[详细]
-
快讯丨TAF治疗4年的肝细胞癌发生率低于TDF
5月17日,在第十届全国疑难及重症肝病大会上,我国香港大学司徒伟基教授交流...[详细]