k-ras突变的肺癌患者如何进行靶向治疗?
尽管以往的观点认为,k-ras是一个无法征服的靶点,但是在最近几年,在靶向治疗浪潮的推动下,k-ras的靶向治疗尤其是针对k-ras G12C也开始出现了新的治疗选择,代表的例子就是索托拉布(sotorasib)与阿德格拉西布(Adagrasib)相继获得批准用于K-ras G12C突变的晚期非小细胞肺癌的二线治疗,从而给更多的包括肺癌在内的高k-ras突变的肿瘤患者带来了信心与希望。
但是,考虑到K-ras抑制剂研发的漫长历程以及这一路上的坎坎坷坷,所以想要客观全面了解k-ras G12C的靶向治疗其实并非易事。基于此,在下文中,我们将结合最新的循证医学证据从临床应用的角度对k-ras抑制剂的治疗进行分析,希望能够对大家提供一定的帮助。
1. K-ras突变背景
Ras癌基因突变在实体瘤中普遍存在,其中80%以上为K-ras突变[1]。目前报道的数据显示,实体瘤中k-ras突变最高的三个瘤种分别为胰腺癌(88%),结直肠癌(45-50%)以及肺癌(31-35%)[2]。K-ras突变在非小细胞肺癌中比例约为20-40%,其突变具有明显的人群分布特点,腺癌(20-40%)相比于鳞癌高发(低于5%),吸烟相对于不吸烟人群高发(30% vs 11%),西方人相比于东方人种高发(26% vs 11%)。
K-ras突变在晚期非小细胞肺癌中存在多种亚型,常见的类型为G12C(42%),G12V(18%),G12F/D(17%),G13X(7%),Q61X(7%),G12A(5%),以及其它类型(4%)。
2.代表性药物:索托拉布
尽管K-ras在实体瘤中突变比例高,但是,由于k-ras突变信号通路的复杂性,在成药性方面一直未能有突破。直到CodeBreak100[3]研究的顺利开展,2021年5月28日FDA才加速批准索托拉布用于K-ras G12C突变的晚期非小细胞肺癌的二线治疗。同年的6月NEJM也在线完整公布了CodeBreak100的临床研究结果,结果显示960mg的索托拉布对K-ras G12C突变的晚期肺癌的有效率,DCR,PFS,OS分别为37.1%,,80.6%,6.8m以及12.5个月。
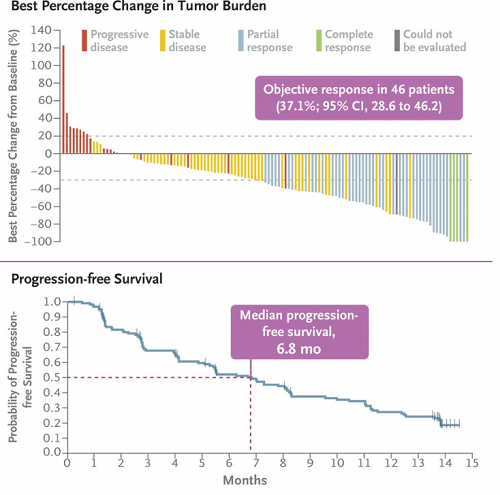
安全性方面,其常见毒副反应为腹泻,呕吐,肝功能异常等,其中3度或者4度以上的毒副反应发生率为20%左右。但是在获得加速审批后不久,索托拉布就遭受了剂量过大(960mg)的质疑,专家给出的理由就是剂量大不仅增加治疗费用,疗效并没有显著的提高,画外音实际上是在说索托拉布在早期的临床研究并没有经过严格的剂量探索,这也为后续的剂量优化埋下了伏笔。
在CodeBreak100数据发表的10个月之后也就是在2023年2月7日,Codebreak200[4]的结果也于lancet在线发表,尽管索托拉布对比多西他赛显著提高了k-ras G12C晚期非小细胞肺癌二线治疗的ORR(28.1% vs 13.2%),DCR (82.5% vs 60.3%) ,PFS(5.6m vs 4.5m),TTP中位起效时间(1.4m vs 2.8m)以及中位有效持续时间(8.6m vs 6.8m),但是关键截点OS (10.6m vs 11.3m)其实并没有改善,所以索托拉布又开始遭受了疗效的质疑。
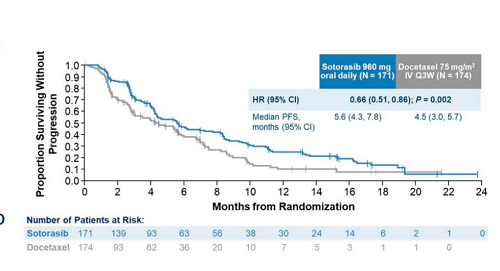
虽然索托拉布没有改善OS确实有点意外,但是仔细思考其原因也在情理之中,无外乎临床研究病情进展后治疗交叉率过高以及后续治疗模式的影响这两大原因。考虑到其在晚期非小细胞肺癌单药有效率在30%以上,其实在临床中还是具有比较大的应用价值,只是需要考虑性价比的问题,尤其是在该研究中入组患者大都既往已经接受了免疫治疗的情况下。按照目前已有的治疗策略,即便采用化疗联合或者不联合抗肿瘤血管生成治疗也不一定能达到这样的治疗效果,所以索托拉布在晚期肺癌二线治疗中的价值还是不应该被轻易否定。
3.毒副反应的问题
然而事情远不止于此,在剂量与长期疗效遭受双重质疑的同时,索托拉布又受到了毒副反应的牵连,而所谓的毒副反应并不是出在索托拉布自身,因为一方面其严重毒副反应的发生率只有20%,另一方面毒副反应的类型也比较常见,很大程度上是因为受到了既往使用免疫治疗的无辜的牵连,因为这些研究往往都入组了大量的一线接受免疫治疗的患者(比例高达60%以上)。
在Codebreak200研究中毒副反应数据的事后分析中,使用免疫治疗病情进展的患者如果在2.6个月以内就使用索托拉布的话,相比于给药间期在3个月以上的患者严重肝脏毒性的发生率要高(约26%);而且进一步的研究还发现,免疫治疗与索托拉布用药相隔时间越长,发生这种严重毒副反应的可能性就越低。尽管目前出现这种现象的原因还是未知,但是这也还是在提醒我们,k-ras G12C突变的晚期肺癌患者使用索托拉布的话还是要考虑既往使用免疫治疗药物的洗脱期。合理的做法是在免疫治疗停药3个月之后再使用索托拉布才会比较安全,同时k-ras G12C抑制剂与免疫治疗联用时的毒副反应问题也必须在将来的临床研究中引起足够的重视。
4.联合的问题
就在大家以为索托拉布估计快要扛不住的时候,索托拉布又开始悄悄实施联合的战术,目的可谓是一石三鸟,其一可以探索潜在的联合治疗模式,二来也可以验证剂量的合理性(960mg的剂量是否合理),其三将大众视线暂时进行转移以韬光养晦(从肺癌转移到结直肠癌)。
这一次,在运筹帷幄之后索托拉布显然是达到了预期的效果,2023年10月22日在线发表在NEJM上的CodeBreaK 300[5]的临床研究结果显示960mg的索托拉布联合panitumumab(帕尼妥珠单抗,针对EGFR的单克隆抗体)相比于240mg的索托拉布以及化疗不仅显著改善了疗效,同时其毒副反应也未见明显增加。
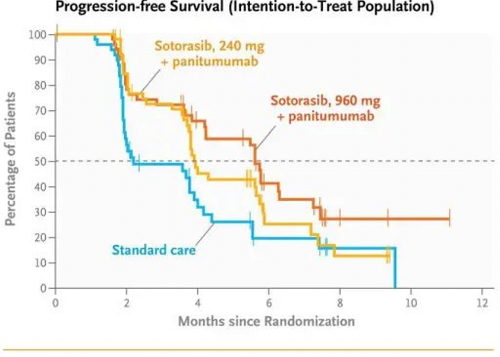
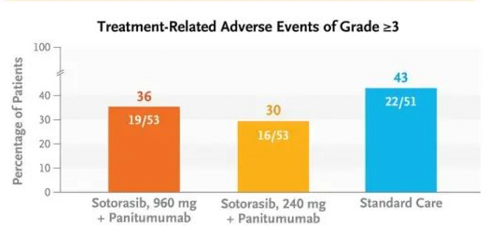
这些数据不仅成功打脸之前专家关于剂量过大的质疑,而且还开辟了k-ras G12C抑制剂联合抗EGFR抗体的又一先河,而且极有可能会成功改写k-rasG12C突变晚期结直肠癌的临床实践,更为重要的是这一模式对很多高k-ras G12C突变的瘤种比如肺癌,胰腺癌等都具有重要借鉴意义。
至此之后,针对k-ras G12C的联合治疗开始出现新的热潮,代表性的就是后续发表在Nature Medicine的Divarasib(GDC-6036)联合cetuximab(西妥昔单抗)的Ib期临床数据(NCT04449874)也得出类似的结论[6]。所以从这一系列的操作来讲,索托拉布其实是一个不择不扣的开拓者,通俗来讲,索托拉布可以说一直在被模仿而且似乎从未被超越。
5.未来的方向
自从索托拉布与阿德格拉西布相继获批之后,k-ras G12C抑制剂的研发也成为了临床研究的热点。相比于早期的索托拉布,后面的药物在疗效方面的数据更加亮眼,比如2023年8月24日在线发表在NEJM上的关于divarasib用于k-ras G12C突变的晚期非小细胞肺癌的I期临床研究(NCT04449874)结果显示,divarasib用于K-ras G12C突变的晚期非小细胞肺癌二线治疗的有效率为53.4%,同时其PFS为13.1个月[7]。
与此同时,其临床应用范围也在不断的扩展,比如除了晚期非小细胞肺癌,divarasib对包括具有k-ras突变的晚期结直肠癌以及其它实体瘤种也显示出不错的疗效。比如在晚期结直肠癌中,divarasib的有效率为29.1%,中位PFS为5.6个月,同时在其它具有k-ras G12C突变的瘤种(胰腺导管癌,肛管癌,胆管癌,子宫内膜鳞状细胞癌,大细胞神经内分泌癌,胃腺癌)的有效率也在30%以上。进一步的检测血液中的ctDNA发现,K-Ras G 12C等位基因的丰度降低可作为预测疗效的早期指标,实际上也将K-Ras G12C抑制剂的研究又向前推进了一小步。
所有这些都表明,索托拉布不仅打开了一扇窗,而且也很可能开了一扇门,未来k-ras G12C甚至有可能会成为继NTRK ,ROS1,BRAF,TMB,Msi-H/dMMR之后的第6个泛靶点,而这一切,显然都离不开索托拉布的开创性工作。
小结
不可否认,k-ras G12C抑制剂的出现已经成功改写了肺癌的临床实践,随着后续的临床研究开展,其影响力有望进一步扩大。但是,尽管k-rasG 12C抑制剂未来可期已是不争的事实,在当前也还存在一些问题,比如耐药机制的阐明,预测疗效的标记物缺乏,联合治疗模式的优化等等,只有这些问题得到解决,k-ras G12C的靶向治疗在变得日趋成熟的同时才能为更多的患者带来生存获益。
参考文献
1. Skoulidis F, Li BT, Dy GK, et al. Sotorasib for Lung Cancers with KRAS p.G12C Mutation. The New England journal of medicine. Jun 24 2021;384(25):2371-2381. doi:10.1056/NEJMoa2103695
2. Sacher A, LoRusso P, Patel MR, et al. Single-Agent Divarasib (GDC-6036) in Solid Tumors with a KRAS G12C Mutation. The New England journal of medicine. Aug 24 2023;389(8):710-721. doi:10.1056/NEJMoa2303810
3. Jänne PA, Riely GJ, Gadgeel SM, et al. Adagrasib in Non-Small-Cell Lung Cancer Harboring a KRAS(G12C) Mutation. The New England journal of medicine. Jul 14 2022;387(2):120-131. doi:10.1056/NEJMoa2204619
4. Dy GK, Govindan R, Velcheti V, et al. Long-Term Outcomes and Molecular Correlates of Sotorasib Efficacy in Patients With Pretreated KRAS G12C-Mutated Non-Small-Cell Lung Cancer: 2-Year Analysis of CodeBreaK 100. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Jun 20 2023;41(18):3311-3317. doi:10.1200/jco.22.02524
5. de Langen AJ, Johnson ML, Mazieres J, et al. Sotorasib versus docetaxel for previously treated non-small-cell lung cancer with KRAS(G12C) mutation: a randomised, open-label, phase 3 trial. Lancet (London, England). Mar 4 2023;401(10378):733-746. doi:10.1016/s0140-6736(23)00221-0
6. Passaro A, Peters S. Setting the Benchmark for KRAS(G12C) -Mutated NSCLC. The New England journal of medicine. Jul 14 2022;387(2):180-183. doi:10.1056/NEJMe2207902
7. Soulières D, Gelmon KA. Sotorasib: Is Maximum Tolerated Dose Really the Issue at Hand? Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Nov 1 2021;39(31):3427-3429. doi:10.1200/jco.21.02072
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
“CONTACT”力度不够,深挖才能解决肺癌治疗难题
在经过了漫长的等待之后,CONTACT-1[1]研究(阿替利珠单抗联合卡博...[详细]
-
低体积转移性荷尔蒙敏感性前列腺癌患者的前列腺放疗探讨
前列腺癌(PCa)是男性中最常见的恶性肿瘤之一,尤其在全球范围内的发展中国...[详细]

