【诊疗知识】神经内分泌肿瘤
一、神经内分泌肿瘤简介
神经内分泌肿瘤是一类起源细胞遍布于神经系统和内分泌系统的肿瘤,可以产生和分泌常见的激素。最常见的肿瘤发生部位为消化系统和支气管-肺区域。神经内分泌肿瘤的发病率不断上升,在美国为仅次于大肠癌的第二大胃肠道肿瘤。大部分神经内分泌肿瘤生长缓慢,早期难以发现,通常都是在已经发生转移之后才诊断出来,淋巴结合肝脏是最常见的转移部位。提示神经内分泌肿瘤的临床表现有:潮红、腹泻、腹痛、消化不良、脂肪泻、气喘、溃疡、低血糖、风疹、糙皮病、咖啡牛奶斑等。
原发灶的完全性手术切除是最主要的治疗手段。
二、神经内分泌肿瘤病因
神经内分泌肿瘤的病因未明。多为散发,少数可见家族聚集性。神经内分泌肿瘤起源于胰岛细胞、胃肠组织(来源于整个肠道的弥漫性神经内分泌细胞)、呼吸道上皮细胞内的神经内分泌细胞和分布在甲状腺的滤泡旁细胞(这类肿瘤被称为甲状腺髓样癌)。
三、神经内分泌肿瘤病理解剖
3.1神经内分泌肿瘤镜下特点
肿瘤细胞较小,呈多边形、卵圆形,胞浆中等量,核圆较深染,染色质分布较均匀,无明显核仁。细胞排列方式可呈实心巢状、结节状、菊形团状等。核分裂像少见。
3.2 小细胞NEC镜下特点
小或中等大小癌细胞,像淋巴细胞,大小约十成熟淋巴细胞的2倍,胞浆少,弥漫性或呈巢状生长。核分裂像常见,坏死比较常见,1/4的病例混杂少量(<30%)腺癌或鳞癌成分。典型的小细胞癌HE即可判断。
3.3 大细胞NEC镜下特点
肿瘤由大细胞组成,大细胞可呈巢状、小梁状、菊团形状和栅栏状排列。与小细胞癌相比,LCNECs细胞的胞质丰富,核空泡化明显,核仁突出,常可见到局部的坏死。必须有两个神经内分泌标记物(CgA,Syn,CD56)阳性才能诊断为LCNEC.
四、神经内分泌肿瘤分类分型
4.1 神经内分泌肿瘤按组培起源分类
胰腺神经内分泌肿瘤(属于中肠)
-胃泌素瘤
-胰岛素瘤
-胰高血糖素瘤
-VIP瘤
-生长抑素瘤
-胰多肽瘤
其他神经内分泌肿瘤
-前场肿瘤
肺
胃
十二指肠起始部
-中肠肿瘤
十二指肠降段
空肠
回肠
右半结肠
-后肠肿瘤
横结肠,左半结肠,乙状结肠
直肠
4.2NCCN指南中的神经内分泌肿瘤病理分类
分为8个类别(每类均有各自的治疗推荐)
-类癌(非胰腺NEN)
-胰岛细胞瘤(胰腺内分泌瘤)
-原发部位不明的神经内分泌瘤
-肾上腺肿瘤(包括肾上腺皮质瘤和肾上腺偶发瘤)
-嗜铬细胞瘤/副神经节瘤
-分化差(高分级或恶性)/小细胞肿瘤
-多发性神经内分泌瘤I型(MEN1)
-多发性神经内分泌瘤II型(MEN2)
五、神经内分泌肿瘤按症状分类
神经内分泌肿瘤可以大体被分为有临床症状和无临床症状2类,术语描述为有功能型和无功能型。
5.1 无功能型
可能是胰腺或非胰腺的神经内分泌肿瘤
没有特异性症状
部分晚期神经内分泌肿瘤患者可以保持多年没有症状
经常表现为晚期患者,可能与血清高水平胰腺多肽相关。
5.2 功能型
胰腺神经内分泌肿瘤:因过多释放激素引起症状
-可能包括胰岛素瘤、胃泌素瘤、VIP瘤、胰高血糖素瘤或类癌综合症,基于其分泌的激素可能很特征化的描述这些综合症
其他神经内分泌肿瘤:分泌5-羟色胺和其他血管活性物质引起的症状
-症状可能包括阵发性潮红、喘鸣、腹泻和最终的右侧心瓣膜病变。
六、神经内分泌肿瘤问诊与查体
6.1 神经内分泌肿瘤关键诊断因素
6.1.1 突触素阳性表达
突触素式一种突出囊泡膜蛋白,在所有正常的和肿瘤的神经内分泌细胞中均可出现,在神经内分泌肿瘤中广泛表达。
6.1.2 嗜铬粒蛋白A阳性表达
嗜铬粒蛋白A是一种位于基质中的大分泌颗粒(>80nm)中的蛋白,与突触素不同,在肿瘤细胞的胞浆中呈不均匀表达甚至不表达,直肠神经内分泌肿瘤中常缺乏表达,在大多数具有大量分泌颗粒的分化良好的神经内分泌肿瘤中呈强阳性
6.1.3 Ki67/MIB1阳性表达
一种在细胞核中表达的具有细胞周期依赖性的标志物,用于区分肿瘤细胞分化增殖的程度。
七、神经内分泌肿瘤辅助检查
7.1 优先检查
7.1.1常规成像
检查描述:
CT、MRI、超声、血管造影
意义
小于1cm的胰腺神经内分泌肿瘤的成功率低于50%
7.1.2 神经内分泌标志物的免疫染色
检查描述:
突触素:一种突出囊泡膜蛋白,在所有正常的和肿瘤的神经内分泌细胞中均可出现,在神经内分泌肿瘤中广泛表达。
嗜铬粒蛋白A:一种位于基质中的大分泌颗粒(>80nm)中的蛋白,与突触素不同,在肿瘤细胞的胞浆中呈不均匀表达甚至不表达,直肠神经内分泌肿瘤中常缺乏表达,在大多数具有大量分泌颗粒的分化良好的神经内分泌肿瘤中呈强阳性
意义
诊断神经内分泌肿瘤的必备条件
7.1.3 增值标志物的免疫染色
检查描述:
Ki67/MIB1:一种在细胞核中表达的具有细胞周期依赖性的标志物
意义:
用于区分肿瘤细胞分化增殖的程度
7.2 可选检测
7.2.1 生长抑素受体扫描(SRS)
检查描述:
>80%的胰腺神经内分泌肿瘤(胰岛瘤除外)过表达SR(特别是R2,5)
用于探查原发性(胰岛瘤除外)和转移性(肝、骨等)胰腺神经内分泌肿瘤[1]
意义
敏感度高:可探查50%至80%原发性胰腺NEN(胰岛瘤或十二指肠胃泌素瘤较少)和超过90%转移性疾病。
7.2.2超声内镜(EUS)
意义:
对于定位胰岛瘤特别有效(可识别出约90%的胰腺内神经内分泌肿瘤)
7.2.3术中定位
检查描述:
术中超声
意义
用于胰腺神经内分泌肿瘤和小的十二指肠肿瘤(特别是十二指肠胃泌素瘤)
7.2.4 激素免疫染色
检查描述:
胰岛素、胃泌素、5-羟色胺和其他等激素的免疫染色
意义:
用于激素综合症、原灶不明肝转移或伴有激素综合征的肿瘤随访
5-羟色胺:首先提示非常原发可能
胃泌素:提示十二指肠或胰腺原发可能
胰高血糖素/胰多肽:提示胰腺原发可能
7.2.5 生长抑素受体的免疫染色
检查描述:
SSTR2阳性的GEP-神经内分泌肿瘤在多数情况下可进行奥曲肽扫描检查
意义:
诊断性/治疗性的肿瘤处理
7.2.6血管标志物的免疫染色
意义:
有助于检验肿瘤的血管侵犯情况
八、神经内分泌肿瘤诊断标准
诊断神经内分泌肿瘤的必备条件
组织病理学
分化好
分化差
表达NE标记物
突触素(Synaptophysin,Syn)
嗜铬粒细胞(Chromogranin,CgA)
增殖活性
G1-G3
分期
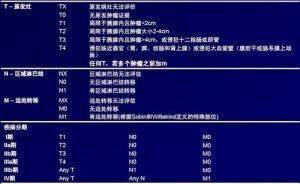
pTNM
神经内分泌肿瘤的TNM分期
九、神经内分泌肿瘤治疗目标
对于局限期病变,手术室局限性肿瘤的主要治疗手段,并且可能达到治愈,可根治性切除患者的5年生存期达到80-100%.大部分GEP-神经内分泌肿瘤患者为转移性疾病。但手术仍然在降低肿瘤体积中起重要作用,可以在药物治疗之前或同时进行手术治疗。
若能够进行R0切除,切除转移病灶是一种治愈的潜在选择。其他减瘤手段也是极为重要的,如射频消融术和肝转移灶的栓塞/化疗栓塞。部分选择性病例可以考虑进行肝移植,如年轻患者、无肝外转移证据并且原发灶可切除。
十、神经内分泌肿瘤治疗细则
胰腺神经内分泌肿瘤的治疗
10.1NCCN对原发性胰腺神经内分泌肿瘤的推荐
10.1.1 治疗方法:手术切除,同时治疗激素过量引起的症状
依据:原发性和局部复发病灶
10.1.2 治疗方法:放射治疗
依据:对于无法切除的局限在区域性的病变,用来控制症状
10.1.3 治疗方法:临床试验
依据:用于无法手术切除的局限在区域性的病变和转移性病灶
*全部为2A类证据推荐
10.2NCCN对无法切除和或转移性胰腺神经内分泌肿瘤的推荐
10.2.1 治疗方法:生长抑素类似物*
例如:奥曲肽
依据/注意:主要目的是缓解症状,对肿瘤进展的影响有限
10.2.2 治疗方法:化疗药物#
例如:卡倍他滨;链脲霉素;阿霉素;达卡巴嗪;5-氟尿嘧啶;替莫唑
依据/注意:细胞毒性化疗药物作用有限
10.2.3 治疗方法:靶向药物**
例如:依维莫司舒尼替尼
依据/注意:III期临床试验
10.2.4 治疗方法:肝脏介入治疗***
例如:动脉栓塞,放射性栓塞,化疗栓塞,局部消融治疗
依据/注意:可作为肝脏转移为主要病变患者的姑息性治疗选择
10.2.5 治疗方法:伴或不伴双磷酸盐的放射治疗
依据/注意:疼痛的骨转移##
*2B类证据;#2A类证据;**证据等级未确定
***除局部消融治疗外,均为2A类证据
##对有症状的疾病为2A类证据,对无症状的疾病为2B类证据
十一、神经内分泌肿瘤治疗进展
实体瘤的形成必须依赖血管的生成。与正常组织相比,神经内分泌肿瘤s组织中的VEGF过表达。一项回顾性的研究结果表明,VEGF的表达水平与神经内分泌肿瘤s患者的无进展生存时间(PFS)呈负相关。另外,大约70%的CI-神经内分泌肿瘤s患者表达PDGF受体(PDGFR)。由于肿瘤细胞和间质中均存在PDCFR-α,说明自分泌环可能有利于肿瘤生长,而肿瘤周围的间质和毛细血管中的PDGFR-[3表达更强。因此,PDGFR可能是治疗这类肿瘤的一个最佳的靶点。
贝伐珠单抗是人源化的抗VECF单抗,与VEGF家族的A亚型结合并使之失效。一项研究显示,44例晚期、高分化的GI-神经内分泌肿瘤患者随机接受贝伐珠单抗或聚乙二醇IFN-α-2b(0.5mg/kg,1次/周)治疗18周,或直到肿瘤进展。在治疗18周或肿瘤进展后,患者进入两药联合的第二个阶段。结果显示,贝伐珠单抗组的22例患者中,部分缓解(PR)4例,稳定(SD)17例;而在聚乙二醇IFN-α-2b组中,无一例PR.贝伐珠单抗组18周的PFS率高于对照组(95%和68%,P=0.02)。
舒尼替尼是靶向VEGFR1——VEGFR3、PDGFR-α和PDGFR-β、干细胞生长因子受体(c-Kit)、神经胶质细胞系衍化的神经营养因子受体(RET)和类FMS的TK-3(Flt-3)的多靶点酪氨酸激酶抑制剂,具有抗肿瘤和抗血管生成的作用。一个入组107例GEP-神经内分泌肿瘤s患者的多中心Ⅱ期临床研究结果显示,66例以前接受过全身治疗的晚期GEP-p神经内分泌肿瘤s患者,其舒尼替尼治疗有效率为16.7%,TTP为7.7个月。在另一项大规模的国际多中心、双盲的Ⅲ期临床研究中,比较了舒尼替尼和安慰剂治疗6个月内有进展的高分化p神经内分泌肿瘤s患者。结果显示,与安慰剂比较,舒尼替尼可显著延长患者的PFS(5.5和11.4个月,P=0.0001)。经***数据监察委员会建议,该研究提前结束。尽管这项研究不能评价生存时间的差异,但Kaplan-Meier分析显示,舒尼替尼可显著延长患者的生存时间(P=0.02)[3].目前,美国食品与药品管理局已经批准舒尼替尼用于治疗分化好的晚期p神经内分泌肿瘤s.
Raf信号通道的上调与GEP-神经内分泌肿瘤的发病有关。索拉非尼是用于阻滞Raf激酶,靶向VEGFR-2、VEGFR3、PDCFR-β、Flt-3和c-Kit的小分子。在一项入组93例晚期CEP-神经内分泌肿瘤患者的Ⅱ期临床研究中,索拉非尼治疗后的PR率达12%,中位PFS为9.6个月(p神经内分泌肿瘤s为12.7个月,类癌为9.1个月)。Pazopanib是靶向VEGFR1——VEGFR3、PDGFR-α和PDGFR-β、c-Kit的多靶点药物,具有抗肿瘤和抗新生血管生成的双重作用。最近的一项Ⅱ期临床研究中,采用Pazopanib(800mg)及其联合奥曲肽LAR(1次/月)分别治疗高分化GI-神经内分泌肿瘤和p神经内分泌肿瘤患者。结果显示,20例GI-神经内分泌肿瘤患者无一例有效;而在30例接受Pazopanib联合奥曲肽LAR治疗的p神经内分泌肿瘤患者中,PR5例(17%),中位PFS为11.7个月。
PI3K/Akt/mTOR通路在调控肿瘤细胞的增殖、生长、代谢、运动和生存中起关键作用,在p神经内分泌肿瘤的形成和发展中有重要作用。第一个治疗p神经内分泌肿瘤的mTOR抑制剂是Temsirolimus.在一项入组36例晚期CEP-神经内分泌肿瘤患者的Ⅱ期临床研究中,Temsirolimus采用25mg、静滴、每周1次的给药方案。结果显示,p神经内分泌肿瘤的有效率和SD率分别为6.7%和60%,GI-神经内分泌肿瘤则分别为4.8%和57.1%.GI-神经内分泌肿瘤和胰腺肿瘤的中TTP分别为10.6和6个月。在另一个mTOR抑制剂依维莫斯(RADO01)的Ⅱ期临床研究中,采用RADO01联合奥曲肽LAR治疗67例晚期低、中分化GEP-神经内分泌肿瘤患者,其有效率和SD率分别为22%和70%,中位生存时间为60周。这个结果推动了RADO01治疗晚期神经内分泌肿瘤的临床研究,即RADIANT项目。RADIANT项目由3个试验组成,其中RADIANT-1是针对晚期p神经内分泌肿瘤的Ⅱ期临床研究。第一组的115例患者接受RADO01单药10mg/d,第二组的45例患者接受相同剂量的RADO01+奥曲肽LAR.结果显示,第一组患者的有效率为9.6%,SD率为67.8%,中位PFS为9.7个月。尽管这个研究的目的并非是要比较两组患者的疗效,但结果提示,联合组的疗效更好,中位PFS为16.7个月,临床获益率为84.4%.RADIANT-2比较的是奥曲肽LAR±RADO01治疗晚期类癌的疗效,结果显示,奥曲肽LAR+RADO01的PFS为16.4个月,显著长于奥曲肽LAR单药(11.3个月,P=0.026)。而RADIANT-3是RADO01对比安慰剂治疗进展期p神经内分泌肿瘤的Ⅲ期随机对照研究,结果显示,RADO01降低了65%的疾病进展风险,中位PFS是安慰剂组的2.4倍(11.04和4.6个月)。
目前,正在研究的几个肿瘤通路中,类胰岛素生长因子受体(IGFR)是GEP-神经内分泌肿瘤治疗最有希望的靶点之一。IGFR在神经内分泌肿瘤中过表达,能促进细胞生长,抑制凋亡,调控细胞的黏附和运动。有研究表明,抑制IGFR-1通路能诱导神经内分泌肿瘤s细胞系的凋亡和细胞周期的阻滞。MK-0646是阻断IGFR-1的单抗,在一个针对晚期GI-神经内分泌肿瘤和p神经内分泌肿瘤的小型Ⅱ期临床研究中,入组了25例患者,其中SD(>6个月)5例。
十二、神经内分泌肿瘤预后
胰腺神经内分泌肿瘤的中位生存期为38个月,SEER数据库分析了1274例患者,发现分期:局部病变、区域性病变和远处病变是生存期的预后因素[1].疾病期别越晚预后越差
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
- 相关阅读
- · 大肠癌的中医分证论治
- · 2016年中医执业医师综合笔试:大肠癌中医诊断
- · 大便异常不可掉以轻心!
- · 2015年临床执业医师教材变动情况-《病理学》
- · 结肠肿瘤的地理分布