快速掌握富马酸丙酚替诺福韦的作用特点
2019-06-13 19:46
阅读:26978
来源:国际肝病网
作者:点*管
责任编辑:IIYI编辑部
[导读]在最新AASLD[1]和EASL慢乙肝指南[16]中,TAF作为一线口服抗病毒药物得到推荐。并且,伴肾功能不全或骨病或存在肾功能不全或骨病风险的患者应考虑使用TAF或ETV,而不是TDF。正在使用TDF治疗的患者若有潜在的肾脏损害或骨病或有肾损害或骨病风险,应考虑转换至ETV或TAF(如果既往有核苷类似物暴露史,应选择TAF)。
2019年1月12日,韦立得
(富马酸丙酚替诺福韦,TAF)在北京、上海、广州、成都、武汉、西安等城市,六地联动共同举办韦立得区域上市会。TAF真正服务我国慢性乙型肝炎(慢乙肝)患者的步伐越来越近。本文根据已公布的相关临床数据总结了TAF的特点,希望能给医生的临床工作提供一些便利。
TAF特有的靶向肝脏机制赋予其高效安全的特征
TAF的体外血浆半衰期达90min,显著长于TDF的0.4min,在血浆中更稳定。TAF能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、全身暴露减少,因此肾脏和骨骼毒性下降[1]。1b期研究发现,≤25mg的TAF能达到与300mg的TDF相似的病毒抑制,但TFV的暴露减少90%以上[2]。对机制的进一步研究[3]显示,TAF能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取TAF,摄取率约65%[4]。
TAF的抗病毒疗效与TDF相似
TAF的全球III期临床研究[5]和我国III期研究[6,7]显示,25mg的TAF抑制HBV**的作用与300mg富马酸替诺福韦二吡呋酯(TDF)相当,二者均具有卓越的抗病毒作用。
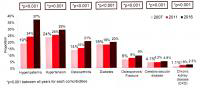
全球研究中,治疗144周时,TAF组和TDF组的病毒学应答率(HBVDNA<29IU/mL)在HBeAg阴性人群分别为87%(TAF)和85%(TDF),P=0.71,在HBeAg阳性人群分别为74%(TAF)和71%(TDF),P=0.59,如图1。
TAF具有更高的生化学应答
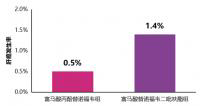
TAF与TDF相比,能取得更高的ALT复常率(男性≤35U/L,女性≤25U/L),治疗为71%(HBeAg阴性)和64%(HBeAg阳性),TDF组为59%(HBeAg阴性)和53%(HBeAg阳性),P值为0.052(HBeAg阴性人群)和0.01(HBeAg阳性人群)。如图2。
最近对ALT复常与肝癌风险的关系得到了很多热议和关注。例如,AASLD2018上韩国学者报告[8],ALT复常是预测慢乙肝肝癌发展的***替代性指标。同期来自欧洲的研究提示,慢乙肝治疗1年时ALT是否恢复正常与HCC***相关[9]。我国香港学者的研究表明,慢乙肝治疗1年时ALT是否恢复正常与HCC***相关[10]。而在2018年年底引起热议的发表于JAMAOncology的文章中[11],TDF治疗后比恩替卡韦能显著降低更多肝癌风险(推测核苷酸类似物产生的干扰素λ3样作用可能也是其中一个原因),而分析显示,TDF治疗的ALT复常率更高,并且ALT是影响HCC发生的因素。上述结果的临床意义值得借鉴和参考,也期待中国大陆的研究数据能够进一步探索阐明。
TAF治疗144周“零”耐药
TAF全球III期临床试验[12]中,治疗144周未检测到与TAF耐药有关的变异,突变病毒的表型分析中TAF的敏感性未见下降,意味着TAF治疗144周保持“零”耐药。我国慢乙肝患者治疗96周同样未发现耐药。
TAF的肾脏、骨骼安全性显著优于TDF
TAF对比TDF治疗慢乙肝的III期临床试验48周、96周和144周的结果均一致显示,TAF治疗的肾脏安全性和骨骼代谢的相关参数性均显著优于TDF。与TDF组相比,TAF治疗对肾脏功能的影响显著更小,eGFRCG的下降更少(图3),近端小管蛋白尿标志物的变化更小。
同样,TAF治疗对骨密度的影响也显著更小,治疗3年,TAF组的脊柱和髋关节的BMD变化轻微,而TDF组呈明显下降(图4)。
不仅如此,TDF治疗的患者换用TAF后,肾脏和骨骼的安全性指标均持续改善,说明原本受到影响的肾脏功能和骨骼代谢均得到恢复。
TAF安全性良好,适用人群更广
除具有良好的肾脏和骨骼安全性外,TAF治疗慢乙肝的整体安全性和耐受性好,绝大部分不良事件为轻~中度[13]。
因应用TDF时曾有过乳酸性酸中毒和伴脂肪变性的严重肝肿大病例报道[14],TAF上市之初FDA也就这两种情况在TAF标签中做出了黑框警告。TAF上市不到半年,2017年4月,美国FDA同意取消了这部分黑框警告的内容[15],目前在中国已经获批的TAF说明书中,没有黑框警告。但说明书中也提到,任何患者的临床或实验室结果如果提示使用TAF治疗过程中,如有乳酸性酸中毒或显著的肝毒性(可能包括肝肿大和脂肪变性,即便转氨酶没有显著升高),应当暂停TAF治疗。
此外,TAF用于HBV母婴阻断的相关临床研究正在进行中,目前数据尚不充分(少于300例),但根据说明书中对于生育、生殖的动物研究数据以及TDF的母婴阻断数据,TAF说明书中建议如有需要,可以考虑在妊娠期间使用[13]。
TAF卓越的安全性还体现在[13]:
●无需针对年龄为65岁及以上的患者调整剂量。
●轻、中、重度肾功能不全患者无需调整剂量。
●没有观察到TAF治疗的患者出现近端肾小管病变或范可尼综合征。
●无需针对肝功能损害患者调整剂量。
●关于生殖毒性,动物研究未发现TAF存在直接或间接有害影响。
指南推荐
在最新AASLD[1]和EASL慢乙肝指南[16]中,TAF作为一线口服抗病毒药物得到推荐。并且,伴肾功能不全或骨病或存在肾功能不全或骨病风险的患者应考虑使用TAF或ETV,而不是TDF。正在使用TDF治疗的患者若有潜在的肾脏损害或骨病或有肾损害或骨病风险,应考虑转换至ETV或TAF(如果既往有核苷类似物暴露史,应选择TAF)。
参考文献
1.TerraultNA,LokAS,McMahonBJ,etal.UpdateonPrevention,Diagnosis,andTreatmentandofChronicHepatitisB:AASLD2018HepatitisBGuidance.Hepatology.2018,https://doi.org/10.1002/hep.29800
2.AgarwalK,FungSK,NguyenTT,etal.Twenty-eightdaysafety,antiviralactivity,andpharmacokineticsoftenofoviralafenamidefortreatmentofchronichepatitisBinfection.JHepatol2014;62:533-540.
3.MurakamiE,WangT,ParkYJ,etal.ImplicationsofEfficientHepaticDeliverybyTenofovirAlafenamide(GS-7340)forHepatitisBVirusTherapy.AntimicrobAgentsChemoth.2015;59(6):3563-3569
4.BabusisD,PhanTK,LeeWA,etal.MechanismforeffectivelymphoidcellandtissueloadingfollowingoraladministrationofnucleotideprodrugGS-7340.MolPharm2013.10:459-466.
5.ChanHL,LimYS,SetoWK,etal.ThreeYearEfficacyandSafetyofTenofovirAlafenamide(TAF)ComparedtoTenofovirDisoproxilFumarate(TDF)inHbeag-NegativeandHbeag-PositivePatientswithChronicHepatitisB.AASLD2018Poster381.
6.HouJL,ZhangLL,DuanZP,etal.APhase3StudyComparingTenofovirAlafenamideWithTenofovirDisoproxilFumarateinPatientsFromChinaWithHBeAg-Positive,ChronicHepatitisB:EfficacyandSafetyResultsatWeek48.APASL2018.HBV-C82
7.NingQ,DuanZP,ChenY,etal.APhase3StudyComparingTenofovirAlafenamideWithTenofovirDisoproxilFumarateinPatientsFromChinaWithHBeAg-Negative,ChronicHepatitisB:EfficacyandSafetyResultsatWeek48.APASL2018.O-HBV-12.
8.ChoiJ,LimYS,HanSB,etal.ComprehensiveAnalysisfortheImpactofon-TreatmentIntermediateEndpointsonOutcomesofHbeag(+)ChronicHepatitisBAASLD2018,Oral267.
9.PapatheodoridisGV,etal.ALTLevelsandRiskofHepatocellularCarcinoma(HCC)inCaucasianChronicHepatitisB(CHB)PatientsUnderLong-TermTherapywithEntecavir(ETV)orTenofovirDisoproxilFumarate(TDF).AASLD2018,Oral265.
10.WongGL,ChanHL,TseYK,etal.Normalon-treatmentALTduringantiviraltreatmentisassociatedwithalowerriskofhepaticeventsinpatientswithchronichepatitisB.JHepatol.2018Oct;69(4):793-802.
11.ChoiJ,KimHJ,LeeJ,etal.RiskofHepatocellularCarcinomainPatientsTreatedWithEntecavirvsTenofovirforChronicHepatitisBAKoreanNationwideCohortStudy.JAMAONcology.2018.Sep27
12.ChanHL,MarcellinP,PanCQ,etal.NoResistancetoTenofovirAlafenamideDetectedthrough144WeeksofTreatmentinPatientswithChronicHepatitisB.AASLD2018.Poster386.
13.富马酸丙酚替诺福韦片(韦立得)产品说明书.2018年版
14.GileadSciences.Prescribing***rmation:VIREAD?(tenofovirdisoproxilfumarate).https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/viread/viread_pi.pdf?la=en
15.GileadSciences.Prescribing***rmation:VEMLIDY?(tenofoviralafenamide).
16.EuropeanAssociationfortheStudyoftheLiver.EASL2017ClinicalPracticeGuidelinesonthemanagementofhepatitisBvirusinfection.JHepatol(2017),http://dx.doi.org/10.1016/j.jhep.2017.03.021
TAF特有的靶向肝脏机制赋予其高效安全的特征
TAF的体外血浆半衰期达90min,显著长于TDF的0.4min,在血浆中更稳定。TAF能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、全身暴露减少,因此肾脏和骨骼毒性下降[1]。1b期研究发现,≤25mg的TAF能达到与300mg的TDF相似的病毒抑制,但TFV的暴露减少90%以上[2]。对机制的进一步研究[3]显示,TAF能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取TAF,摄取率约65%[4]。
TAF的抗病毒疗效与TDF相似
TAF的全球III期临床研究[5]和我国III期研究[6,7]显示,25mg的TAF抑制HBV**的作用与300mg富马酸替诺福韦二吡呋酯(TDF)相当,二者均具有卓越的抗病毒作用。
全球研究中,治疗144周时,TAF组和TDF组的病毒学应答率(HBVDNA<29IU/mL)在HBeAg阴性人群分别为87%(TAF)和85%(TDF),P=0.71,在HBeAg阳性人群分别为74%(TAF)和71%(TDF),P=0.59,如图1。
图1.TAF对比TDF治疗慢乙肝III期研究144周的病毒学应答
TAF具有更高的生化学应答
TAF与TDF相比,能取得更高的ALT复常率(男性≤35U/L,女性≤25U/L),治疗为71%(HBeAg阴性)和64%(HBeAg阳性),TDF组为59%(HBeAg阴性)和53%(HBeAg阳性),P值为0.052(HBeAg阴性人群)和0.01(HBeAg阳性人群)。如图2。
图2.TAF对比TDF治疗慢乙肝III期研究144周的生化学应答
最近对ALT复常与肝癌风险的关系得到了很多热议和关注。例如,AASLD2018上韩国学者报告[8],ALT复常是预测慢乙肝肝癌发展的***替代性指标。同期来自欧洲的研究提示,慢乙肝治疗1年时ALT是否恢复正常与HCC***相关[9]。我国香港学者的研究表明,慢乙肝治疗1年时ALT是否恢复正常与HCC***相关[10]。而在2018年年底引起热议的发表于JAMAOncology的文章中[11],TDF治疗后比恩替卡韦能显著降低更多肝癌风险(推测核苷酸类似物产生的干扰素λ3样作用可能也是其中一个原因),而分析显示,TDF治疗的ALT复常率更高,并且ALT是影响HCC发生的因素。上述结果的临床意义值得借鉴和参考,也期待中国大陆的研究数据能够进一步探索阐明。
TAF治疗144周“零”耐药
TAF全球III期临床试验[12]中,治疗144周未检测到与TAF耐药有关的变异,突变病毒的表型分析中TAF的敏感性未见下降,意味着TAF治疗144周保持“零”耐药。我国慢乙肝患者治疗96周同样未发现耐药。
TAF的肾脏、骨骼安全性显著优于TDF
TAF对比TDF治疗慢乙肝的III期临床试验48周、96周和144周的结果均一致显示,TAF治疗的肾脏安全性和骨骼代谢的相关参数性均显著优于TDF。与TDF组相比,TAF治疗对肾脏功能的影响显著更小,eGFRCG的下降更少(图3),近端小管蛋白尿标志物的变化更小。
图3.TAF对比TDF治疗慢乙肝III期研究144周的eGFR变化
同样,TAF治疗对骨密度的影响也显著更小,治疗3年,TAF组的脊柱和髋关节的BMD变化轻微,而TDF组呈明显下降(图4)。
图4.TAF对比TDF治疗慢乙肝III期研究144周的骨密度变化
不仅如此,TDF治疗的患者换用TAF后,肾脏和骨骼的安全性指标均持续改善,说明原本受到影响的肾脏功能和骨骼代谢均得到恢复。
TAF安全性良好,适用人群更广
除具有良好的肾脏和骨骼安全性外,TAF治疗慢乙肝的整体安全性和耐受性好,绝大部分不良事件为轻~中度[13]。
因应用TDF时曾有过乳酸性酸中毒和伴脂肪变性的严重肝肿大病例报道[14],TAF上市之初FDA也就这两种情况在TAF标签中做出了黑框警告。TAF上市不到半年,2017年4月,美国FDA同意取消了这部分黑框警告的内容[15],目前在中国已经获批的TAF说明书中,没有黑框警告。但说明书中也提到,任何患者的临床或实验室结果如果提示使用TAF治疗过程中,如有乳酸性酸中毒或显著的肝毒性(可能包括肝肿大和脂肪变性,即便转氨酶没有显著升高),应当暂停TAF治疗。
此外,TAF用于HBV母婴阻断的相关临床研究正在进行中,目前数据尚不充分(少于300例),但根据说明书中对于生育、生殖的动物研究数据以及TDF的母婴阻断数据,TAF说明书中建议如有需要,可以考虑在妊娠期间使用[13]。
TAF卓越的安全性还体现在[13]:
●无需针对年龄为65岁及以上的患者调整剂量。
●轻、中、重度肾功能不全患者无需调整剂量。
●没有观察到TAF治疗的患者出现近端肾小管病变或范可尼综合征。
●无需针对肝功能损害患者调整剂量。
●关于生殖毒性,动物研究未发现TAF存在直接或间接有害影响。
指南推荐
在最新AASLD[1]和EASL慢乙肝指南[16]中,TAF作为一线口服抗病毒药物得到推荐。并且,伴肾功能不全或骨病或存在肾功能不全或骨病风险的患者应考虑使用TAF或ETV,而不是TDF。正在使用TDF治疗的患者若有潜在的肾脏损害或骨病或有肾损害或骨病风险,应考虑转换至ETV或TAF(如果既往有核苷类似物暴露史,应选择TAF)。
参考文献
1.TerraultNA,LokAS,McMahonBJ,etal.UpdateonPrevention,Diagnosis,andTreatmentandofChronicHepatitisB:AASLD2018HepatitisBGuidance.Hepatology.2018,https://doi.org/10.1002/hep.29800
2.AgarwalK,FungSK,NguyenTT,etal.Twenty-eightdaysafety,antiviralactivity,andpharmacokineticsoftenofoviralafenamidefortreatmentofchronichepatitisBinfection.JHepatol2014;62:533-540.
3.MurakamiE,WangT,ParkYJ,etal.ImplicationsofEfficientHepaticDeliverybyTenofovirAlafenamide(GS-7340)forHepatitisBVirusTherapy.AntimicrobAgentsChemoth.2015;59(6):3563-3569
4.BabusisD,PhanTK,LeeWA,etal.MechanismforeffectivelymphoidcellandtissueloadingfollowingoraladministrationofnucleotideprodrugGS-7340.MolPharm2013.10:459-466.
5.ChanHL,LimYS,SetoWK,etal.ThreeYearEfficacyandSafetyofTenofovirAlafenamide(TAF)ComparedtoTenofovirDisoproxilFumarate(TDF)inHbeag-NegativeandHbeag-PositivePatientswithChronicHepatitisB.AASLD2018Poster381.
6.HouJL,ZhangLL,DuanZP,etal.APhase3StudyComparingTenofovirAlafenamideWithTenofovirDisoproxilFumarateinPatientsFromChinaWithHBeAg-Positive,ChronicHepatitisB:EfficacyandSafetyResultsatWeek48.APASL2018.HBV-C82
7.NingQ,DuanZP,ChenY,etal.APhase3StudyComparingTenofovirAlafenamideWithTenofovirDisoproxilFumarateinPatientsFromChinaWithHBeAg-Negative,ChronicHepatitisB:EfficacyandSafetyResultsatWeek48.APASL2018.O-HBV-12.
8.ChoiJ,LimYS,HanSB,etal.ComprehensiveAnalysisfortheImpactofon-TreatmentIntermediateEndpointsonOutcomesofHbeag(+)ChronicHepatitisBAASLD2018,Oral267.
9.PapatheodoridisGV,etal.ALTLevelsandRiskofHepatocellularCarcinoma(HCC)inCaucasianChronicHepatitisB(CHB)PatientsUnderLong-TermTherapywithEntecavir(ETV)orTenofovirDisoproxilFumarate(TDF).AASLD2018,Oral265.
10.WongGL,ChanHL,TseYK,etal.Normalon-treatmentALTduringantiviraltreatmentisassociatedwithalowerriskofhepaticeventsinpatientswithchronichepatitisB.JHepatol.2018Oct;69(4):793-802.
11.ChoiJ,KimHJ,LeeJ,etal.RiskofHepatocellularCarcinomainPatientsTreatedWithEntecavirvsTenofovirforChronicHepatitisBAKoreanNationwideCohortStudy.JAMAONcology.2018.Sep27
12.ChanHL,MarcellinP,PanCQ,etal.NoResistancetoTenofovirAlafenamideDetectedthrough144WeeksofTreatmentinPatientswithChronicHepatitisB.AASLD2018.Poster386.
13.富马酸丙酚替诺福韦片(韦立得)产品说明书.2018年版
14.GileadSciences.Prescribing***rmation:VIREAD?(tenofovirdisoproxilfumarate).https://www.gilead.com/~/media/files/pdfs/medicines/liver-disease/viread/viread_pi.pdf?la=en
15.GileadSciences.Prescribing***rmation:VEMLIDY?(tenofoviralafenamide).
16.EuropeanAssociationfortheStudyoftheLiver.EASL2017ClinicalPracticeGuidelinesonthemanagementofhepatitisBvirusinfection.JHepatol(2017),http://dx.doi.org/10.1016/j.jhep.2017.03.021
版权声明:
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
热点图文
-
AASLD2018研究进展丨慢乙肝患者治疗期间的肾脏安全管理
在新药取得成功之前,应用口服核苷(酸)类似物(NA)治疗慢性乙型肝炎(简称...[详细]
-
快讯丨TAF治疗4年的肝细胞癌发生率低于TDF
5月17日,在第十届全国疑难及重症肝病大会上,我国香港大学司徒伟基教授交流...[详细]