抗肾小球基底膜(GBM)抗体肾小球肾炎(GN)是一种罕见的肾小球疾病,发病率为0.5-1 / 100万。它是由针对IV型胶原α3链的非胶原结构域的自身抗体引起的。抗GBM肾小球肾炎可表现为孤立的肾脏疾病或者肺-肾综合征(Goodpasture综合征)。抗GBM肾小球肾炎是一种快速进展的新月体性GN,约80%的患者在一半及以上的肾小球有新月体形成。40%-60%的患者会发生Goodpasture综合征,表现为肾功能不全伴随重症致命的肺出血。抗GBM抗体肾小球肾炎肺部受累在男性中更为常见(约80%),通常发生在起病后的抗gbm肾炎没有明-20年。单纯的抗GBM抗体肾小球肾炎发病率没有明显的性别、年龄差异。如果不进行治疗,抗GBM病的发病率非常高,几乎所有患者都会发展为肾衰竭,而且致死率也相当高。在采用免疫抑制治疗之前,Goodpasture综合征患者的死亡率为96%。在采用免疫抑制治疗后其死亡率为47%。大多数病人死于呼吸衰竭。治疗的根本原则是迅速去除致病的自身抗体并抑制其产生,以防止进一步的肾和肺损伤。2003年成立的改善全球肾脏病预后组织(KidneyDisease:Improving Global Outcomes)颁布了2021年肾小球肾炎的临床指南。其中第十一章对抗GBM病诊断、治疗提出了一些共识。本文介绍了该章节并对每一具体问题做出解读,旨在希望对成年人抗GBM病治疗和管理有些帮助。
诊断
所有急进性肾小球肾炎患者都应考虑抗GBM病,并尽早诊断不能延误。(图1)对所有疑似急进性肾小球肾炎的患者,应立即进行血清学抗GBM抗体检测。有10%的抗GBM病患者可能会出现抗GBM抗体阴性,这部分人群可行肾穿刺活检,病理示IgG沿基底膜线性沉积即可确诊。
肺部受累与否通常可根据临床表现初步诊断,或者通过增强CT确诊。腹腔镜检查和肺功能检查可能有用,但意义不大。对怀疑抗GBM病诊断的患者,临床医生应尽力催促病理科当天出肾活检病理报告(图1)
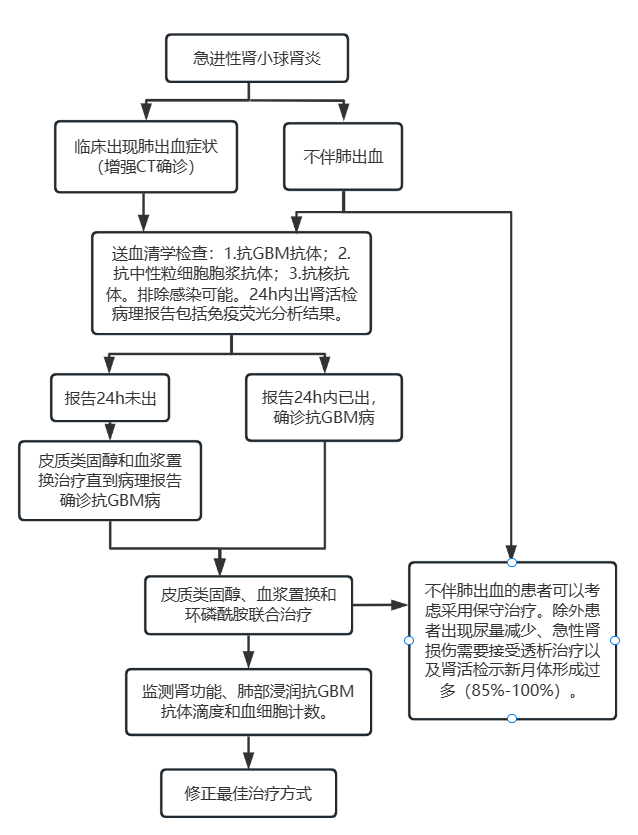
图1 抗GBM病的诊断和治疗。
治疗实践要点
治疗的目的是消除肾脏炎症(皮质类固醇),清除循环致病性自身抗体(血浆置换),抑制自身抗体的形成(免疫抑制剂)。这种治疗方案能够预防肾损伤,但不能逆转已经形成的慢性肾损伤。治疗通常可使肺泡出血完全缓解。在接受血浆置换和免疫抑制治疗的患者中,抗GBM抗体的形成在几个月后或几周内自发停止。该病复发率低 (复发多见于吸烟者),所以不必要进行长期维持免疫抑制治疗。抗GBM抗体持续阴性时进行肾移植,该病复发率非常低。
治疗的获益和风险
未经治疗的抗GBM病有相当高的发病率和死亡率。观察性研究表明通过血浆置换和免疫抑制治疗,抗GBM的早期死亡率从47%下降到8.5%,目前接受治疗后的5年生存率为90%。虽然血浆置换和免疫抑制治疗提高了肾存活率,但相对来说仍然较差,部分原因是诊断和开始治疗时间经常延迟。自2007年以来,接受治疗的患者的5年肾存活率从约25%提高到50%,这可能是因为早期诊断和更多的患者接受血浆置换治疗。血浆置换联合免疫抑制治疗毫无疑问可以提高患者的生存率,且有助于预防肾功能尚可患者的肾衰竭。
治疗中潜在的风险包括与免疫抑制相关的感染和血浆置换后出血。所以推荐在血浆置换后给予新鲜冷冻血浆,尤其是在肺泡出血和肾活检后的患者中。因为未经治疗的抗GBM肾小球肾炎和Goodpasture综合征有很高的死亡率和发病率(肾衰竭),因此指南推荐所有患者进行积极的免疫抑制治疗。
实施治疗的注意事项
大多数患者应尽早开始抗GBM病的治疗。然而对具有某些临床和病理特征(如肾活检示大量新月体形成(85% -100%)、少尿和/或需要开始透析的晚期肾衰竭)的患者,其肾功能保留和恢复的机率很低,仅约5%。对于这样的患者,决定治疗方案时应综合考虑患者肾功能恢复的低可能性以及患者对积极免疫抑制治疗的耐受度。然而如果这些患者伴有肺出血,则治疗是必要的。抗GBM病在白种人患者中更为常见。在我国,这种疾病多见于老年人。该病并发肺部疾病在吸烟者中更为常见。有趣的是,肺部受累与较好的肾脏预后相关,可能是因为其临床症状有助于早期诊断。肺肾综合征多见于年轻男性,而孤立的抗GBM肾小球肾炎多发生在老年人中。
1.1还未确诊但临床怀疑抗GBM病时即应立刻开始治疗。
抗GBM抗体具有致病性,应尽快将其完全从血液循环中清除。在大多数接受血浆置换联合免疫抑制治疗的患者中,抗体在8周内被清除。抗GBM抗体尽早去除有助于抗GBM病患者肾功能恢复。如果高度怀疑抗GBM病,即使肾活检结果还未确诊,也应立即开始治疗(24小时内)。
1.2血浆置换治疗应持续进行直到抗GBM抗体滴度不能被检测到。
血浆置换可逐渐且相对缓慢(几周内)消除血液循环中的抗GBM抗体,通常需要进行2 - 3周才能使抗GBM抗体完全消失。伴肺泡出血或肾活检后的患者应立即进行血浆置换结合新鲜冷冻血浆输注治疗。另外如果患者输注了白蛋白,在血浆置换结束后也应给予新鲜冷冻血浆。
1.3环磷酰胺用药2 - 3个月,糖皮质激素用药约6个月。(图2)
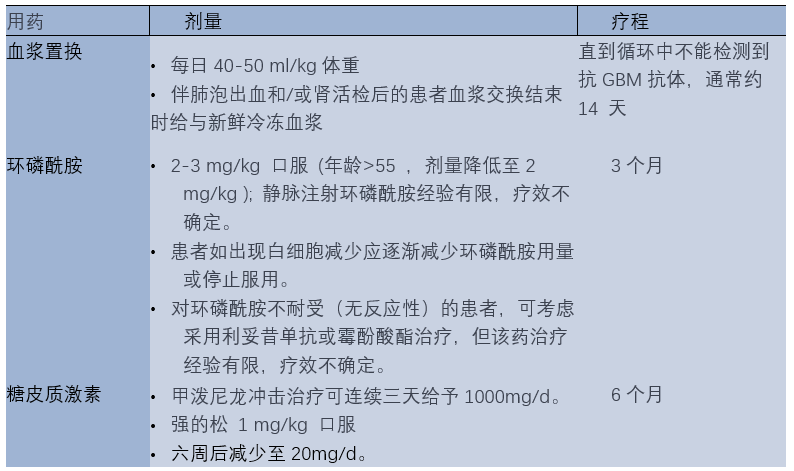
图2 抗GBM病的治疗。
抗GBM抗体的生成在6-9个月的治疗后自发停止。然而根据现有的临床经验,推荐患者每天口服环磷酰胺3个月,并在6个月内逐渐减少糖皮质激素用量,以防止新的抗体产生。
在环磷酰胺治疗3个月后仍存在抗GBM抗体的患者,建议改用硫唑嘌呤或霉酚酸酯(联合糖皮质激素)治疗。使用环磷酰胺治疗的肾衰竭患者发生感染的风险较高,可考虑使用复方新诺明来预防肺孢子虫肺炎。在血浆置换治疗过程中发生严重感染的患者,可考虑在抗生素的基础上加用静脉注射免疫球蛋白治疗。
1.4抗GBM病无需维持治疗。
抗GBM病复发并不常见(0% - 6%)。反复复发可能见于不戒烟或长期暴露于肺部刺激物的患者。不建议对超过6个月未检测出抗GBM抗体的患者进行治疗。临床医生应做好患者教育,严格劝阻患者吸烟。
2.5抗GBM抗体和ANCA双阳性的肾小球肾炎患者应与ANCA相关血管炎(AAV)患者一样接受维持治疗。
抗GBM抗体和ANCA双阳性比较常见。约5%的AAV患者也会有抗GBM抗体阳性,三分之一的抗GBM 肾小球肾炎患者可能是ANCA阳性。这类双抗体阳性患者也可能会有严重的肾脏损害,或者伴有肺出血,但他们比仅抗GBM抗体阳性的患者更可能在透析治疗后恢复肾功能。与仅抗GBM抗体的患者相比,双抗体阳性患者的复发率与AAV患者相似,所以这类患者对于抗GBM病需要积极的早期治疗,然后像AAV一样进行维持免疫抑制治疗。
2.6难治性抗GBM病可尝试使用利妥昔单抗治疗。
难治性抗GBM病较罕见(<10%)。抗GBM病采用利妥昔单抗治疗的经验仅来源于病例报告,其中8例患者对标准治疗反应性不佳,并成功地用利妥昔单抗治疗,4例患者接受透析治疗,主要联合利妥昔单抗而不是环磷酰胺作为一线治疗,以缓解其肺部症状。
2.7 抗GBM病发展成肾衰竭的患者应推迟肾移植,直到连续6个月未检测到抗GBM抗体。
抗GBM病患者肾移植后的生存率与其他病因导致的肾衰竭患者相当。在移植时可检测到抗GBM抗体的患者,移植后抗GBM病的复发率可高达50%,而在没有抗GBM抗体的患者中,肾移植后抗GBM复发非常罕见。
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





