摘要
该病例为一例35岁右侧腹股沟恶性黑色素瘤的患者。2019年3月,患者因发现右侧腹股沟肿物入院,入院后接受右侧腹股沟肿物切除术,术中可见肿瘤有完整包膜,可根治性切除,术后患者定期复查,未予治疗。2021年6月,患者因右下肢新发皮下结节再次入院,CT检查发现肺部转移瘤,行右下肢肿物切除术,术后病理为恶性黑色素瘤,肺部转移瘤未予治疗,患者定期复查。2022年3月,患者发现肺部转移瘤较前增多,4月开始使用帕博利珠单抗免疫治疗,使用帕博利珠单抗9个周期后出现口干、多饮、多尿,查血葡萄糖32.98mmol/L;尿酮体(+++),尿葡萄糖(++++),尿蛋白(±),尿pH值为5.0,考虑为4级免疫相关糖尿病,经胰岛素治疗后血糖控制平稳。
病史
患者,女性,35岁,患者既往无糖尿病、高血压、冠心病等病史。2019年3月因发现右腹股沟肿物入院,余无特殊不适。查体:右侧腹股沟可扪及大小为4cmx3cmx2.5cm类圆形肿物,质硬,活动度可,有完整包膜,无明显压痛,局部皮肤无红肿,破溃及瘘管形成。2019年3月18日接受右侧腹股沟肿物根治切除术,术后病理显示:①右腹股沟肿物及4个淋巴结均可见转移性恶性肿瘤,考虑恶性黑色素瘤可能性大;②(左腿黑痣)送检组织全包切片,镜下见皮下胶原纤维及纤维母细胞增生。免疫组化:HMB45(+),MART-1(+),S100(+)。术后患者定期复查。
再次手术 2021年6月患者因发现右下肢皮下结节7天再次入院,余无不适。查体发现右下肢皮下可触及一大小为0.8cmx0.9cm皮下肿物,表面皮肤正常,单发、质硬,推之不动,与周围组织界限不清。胸部CT示肺部多发转移瘤。于2021年6月9日行右下肢皮下肿物切除术,术后病理提示恶性肿瘤,考虑为恶性黑色素瘤。免疫组化:HMB45(+),MelanA(+),S100(+),CKpan(-),Ki-67(+,约70%)。术后患者拒绝化疗,定期复查。
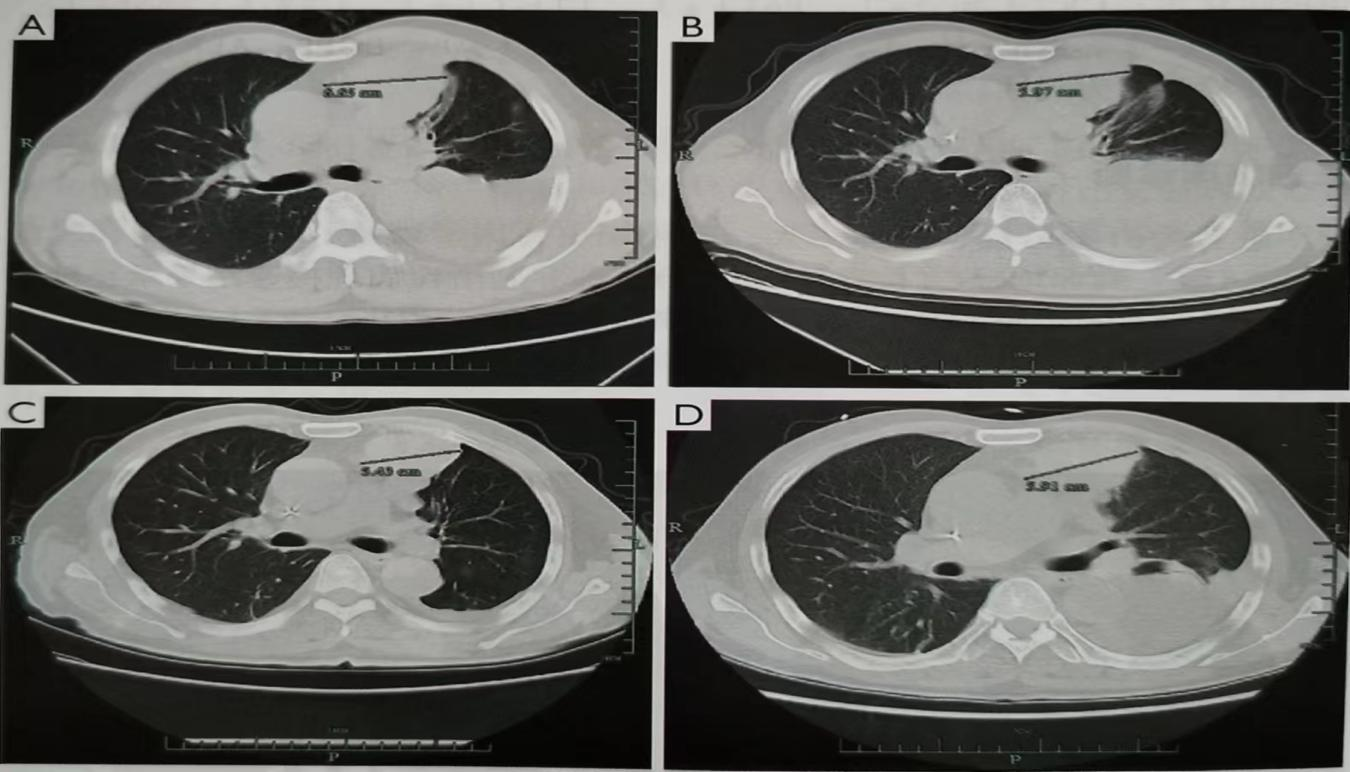
免疫治疗 2022年3月复查发现肺转移瘤增多,遂于2022年4月3日开始予以帕博利珠单抗免疫治疗,经5个周期帕博利珠单抗治疗后肺部转移瘤较前明显缩小及减少(图1)。
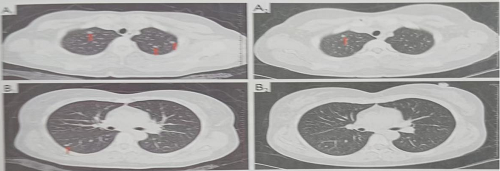
治疗前 治疗后 图1 使用免疫治疗5个周期前后疗效对比 免疫相关性糖尿病酮症酸中毒治疗
患者使用单药帕博利珠单抗免疫治疗9个周期后,于2022年9月中旬出现口干、多饮、多尿、乏力、胸闷不适,且口干、多饮、胸闷、乏力症状逐步加重,伴头晕、恶心、呕吐。 尿常规:尿酮体(KET)+++;尿蛋白(PRO)±;尿葡萄糖++++,尿pH值5.0,余大致正常。血气分析示:pH值7.15,氧分压117mmHg,二氧化碳分压17mmHg,血乳酸1.1mmol/L,标准碳酸根9.4mmol/L,实际碳酸氢根5.8mmol/L,标准剩余碱-21.5mmol/L,实际剩余碱-22.2mmol/L。肾功能检查结果示:血碳酸氢根浓度14mmol/L,钾离子3.6mmol/L,钠离子142mmol/L,血清氯120mmol/L,阴离子间隙6,β2微量球蛋白0.73mg/L,内生肌酐清除率170.4mL/min。肝功能检查结果示:总蛋白49g/L,白蛋白29.8g/L,球蛋白19.2g/L,前白蛋白54mg/L,余大致正常。C肽0.07ng/ml,血糖32.98mmol/L,糖化血红蛋白(HbAlc)为9.71%。胰岛素自身抗体未见异常。根据患者病史、症状、尿酮体、糖化血红蛋白、糖尿病自身抗体检查,患者诊断为免疫相关糖尿病、糖尿病酮症酸中毒已十分明确。入院后立即使用胰岛素控制血糖,于2022年10月8日,开始予以胰岛素泵控制血糖,同时予以补液等对症支持处理。使用4天后,于2022年10月12日,停掉胰岛素泵改为门冬胰岛素30注射液早、晚各14U控制血糖,经治疗患者空腹血糖控制在9~11mmol/L,餐后血糖控制在10~13mmol/L,口干、多饮、多尿、头晕、恶心、乏力、肢体麻木症状基本缓解。
预后和随访
患者血糖控制尚可,空腹血糖控制在6~9mmol/L,餐后血糖控制在7mmol/L左右。目前胰岛素方案为:早上、中午门冬胰岛素注射液各8U;晚上地特胰岛素12U。肿瘤治疗方面,患者已于2022年10月开始停用帕博利珠单抗,定期复查。
讨论
免疫检查点抑制剂(ICIs)作为一种新型的抗肿瘤药物,在过去的十年里,因为良好的耐受性,一跃成为肿瘤治疗的“中流砥柱”,在多种恶性肿瘤中疗效显著[1-2]。现常用的两种免疫检查点抑制剂是PD-1、PD-L1抑制剂。PD-L1在多种肿瘤中广泛表达,其中在恶性黑色素瘤中的表达率为38%-100%[3]。一项临床研究显示,使用帕博利珠单抗免疫治疗的初治恶性黑色素瘤患者的5年总生存率达到41%,初治恶性黑色素瘤患者的完全缓解率达25%[4]。
免疫相关糖尿病的可能机制
由于ICI特定的作用目标及作用机制,可引起自身免疫和炎症效应,称为免疫相关不良反应(irAEs)。免疫相关不良反应发生的机制众多,主要有以下几种:①激活的T细胞除攻击肿瘤,同时也攻击与肿瘤表达相同抗原的组织;②细胞因子释放增加导致炎症损伤;③诱发补体介导细胞毒效应,引发不良反应;④调节体液免疫功能,促进抗组织抗体产生。免疫治疗相关性糖尿病是内分泌系统免疫治疗相关不良反应中的一种,其发生的主要原因为机体失去免疫耐受和自身免疫性破坏胰腺β细胞或胰岛素信号通路的失调导致胰岛素抵抗[5]。有研究显示,免疫治疗相关性糖尿病出现临床表现的平均时间是在起始治疗后的8.5周(1周~12个月),75%的患者以糖尿病酮症酸中毒起病[6]。
糖尿病酮症酸中毒诊断及治疗
本例患者术后未接受辅助治疗,出现肺部转移瘤后9个月才接受帕博利珠单抗免疫治疗。使用5个周期免疫治疗后肺部转移瘤明显缩小及减少,疗效良好。患者使用免疫治疗9个周期(即5个多月)后出现口干、多饮、多尿症状,查血示:葡萄糖32.98mmol/L;尿酮体(+++),尿葡萄糖(++++),尿蛋白(±),尿pH值5.0,考虑为4级免疫相关糖尿病。国外有学者报道,在回顾分析的24例免疫相关性糖尿病患者中,糖化血红蛋白均升高,同时有41.5%的患者出现C肽低水平或检测不出,提示免疫相关糖尿病患者的胰腺β细胞极度衰竭[6]。因此,免疫相关糖尿病患者一旦诊断,建议立即启用胰岛素治疗,必要时使用胰岛素泵处理。本例患者发现血糖升高时已处于酮症酸中毒状态,入院后查C肽示C肽处于极低水平,提示该例患者的胰岛功能处于衰竭状态,立即使用胰岛素泵控制血糖,同时予以补液等对症处理,患者酮症状态得以快速纠正,血糖逐步下降,未出现高渗昏迷等严重并发症。 免疫相关糖尿病患者早期可无特殊不适,待出现症状时往往已处于酮症酸中毒状态。因此,建议在使用PD-1/PD-L1抑制剂治疗之前和期间进行糖化血红蛋白和血糖检测。此外,需要进一步的研究来确定治疗前易感性的生物标志物以及自身免疫性糖尿病对这些患者的长期影响。
总结
综上所述,在启用免疫治疗前应全面了解患者的内分泌状态,对胰腺、甲状腺、甲状旁腺、垂体、肾上腺的功能进行评估,以便鉴别是否为免疫相关内分泌不良反应。患者一旦确诊为免疫相关性糖尿病,应立即使用胰岛素控制血糖。 参考文献 [1]Simpson GR,Relph K,Harrington K,et al. Cancer immunotherapy via combining oncolyticvirotherapy with chemotherapy:recent advances[J].Oncolytic Virother,2016,5:1-13. [2] Au TH,Wang K,Stenehjem D,et al. Personalized and precision medicine:integratinggenomics into treatment decisions ingastrointestinal malignancies[J].J Gastrointest Oncol,2017,8(3):387-404. [3]Patel SP,Kurzrock R.PD-L1 expression as a Predictive Biomarker in CancerImmunotherapy[J].Mol Cancer Ther,2015,14(4):847-856. [4]Robert C,Ribas A,Wolchok JD,et al.Anti-programmed-death-receptor-1 treatmentwith pembrolizumab in ipilimumab-refractory advanced melanoma:a randomised dose-comparison cohort of a phase 1 trial[J].Lancet,2014,384(9948):1109-1117. [5]Shariff AI,Syed S,Shelby RA,et al.Novel cancer therapies and their association withdiabetes[J].J Mol Endocrinol,2019,62(2):R187-R199. [6] Gauci ML,Laly P,Vidal-Trecan T,et al.Autoimmune diabetes induced by PD-1 inhibitor- retrospective analysis and pathogenesis: a case report and literature review[J].CancerImmunol Immunother,2017,66(11):1399-1410.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。