病例资料:患者男性,53岁,吸烟史30余年,每日20支;饮酒史30余年。高血压病史10年,最高150/90mmHg,口服氨氯地平,控制可。患者于2017年7月26日体检,胸部CT报告:左上肺尖段结节(8mm),右下肺胸膜下小结节(4mm),2017年7月28日行PET-CT检查:左肺尖及右肺下叶胸膜下小结节,FDG代谢不高,随访观察。2018年3月24日复查胸部CT:左上肺尖段结节增大(12mm).2018年3月30日腹部B超及骨扫描均未见异常。2018年4月28日于外院在全麻下行电视辅助胸腔镜下(VATS)左上肺癌根治术,术后病理:周围型高分化腺癌,肿块直径1.2cm,支气管切缘阴性,支气管周围检及2+/3见癌转移,第4组淋巴结1+/1见癌转移,第5组淋巴结1+/1见癌转移,第7组淋巴结2+/4见癌转移,第10组淋巴结3+/3见癌转移,第11组淋巴结1+/1见癌转移。分子病理:EGFR野生型,ALK(-),ROSI(-)。头颅增强MRI(2018年5月18日):两侧额顶叶皮层下小缺血灶。
诊断:支气管肺癌,原发性,周围型,左肺,腺癌,VATS左上肺癌根治术,pT1bN2M0,IIIA期,PS 1,EGFR野生型,ALK(-),ROSI(-)。
2018年5月25日予以AC方案(培美曲塞860mg+卡铂540mg)化疗,有发热,体温波动在38℃左右,持续2日,血常规正常,未做处理后体温自行恢复正常,偶有干咳,左下肢自觉麻木不适。
2018年6月15日予以第2个周期AC方案化疗,化疗后无不适。
2018年7月10日予以第3个周期AC方案化疗,化疗后出现I度骨髓抑制(血小板计数93x10°/L,血红蛋白100g/L)。
2018年6月20日~2018年7月27日予以纵隔淋巴结引流区放疗(50Gy/28fx),放疗后出现放射性食管炎。
2018年8月1日予以第4个周期AC方案化疗,化疗后出现I度骨髓抑制(血红蛋白108g/L)。
2018年12月初患者出现头晕乏力。
2018年12月17日复查头颅增强MRI:两侧小脑结节性占位,考虑转移瘤可能(图1)。
2018年12月20日~2018年12月26日予以双侧小脑病灶立体定向放疗(SRS)(3000cGy/5f)。复查头颅增强MRI(2019年1月7日):双侧小脑病灶较前缩小,右侧额叶新发病灶伴水肿,考虑复发脑转移。病程中,患者神志清,精神较差,大小便未诉异常,体力下降,体重略有下降。
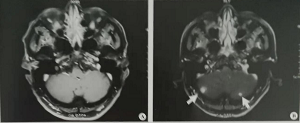
图1:A.2018年5月18日外院头颅增强MRI:B.2018年12月17日头颅增强MRI,可见左侧及右侧小脑分别出现一高信号影,诊断为脑转移瘤
2019年1月7日及2019年1月22日分别给予纳武单抗180mg 2个周期治疗(q2w)。
2019年2月11日复查头颅增强MRI:双侧小脑病灶明显缩小,右侧额叶病灶缩小(图2),疗效评价为PR。
2019年2月11日复查胸部增强CT:左侧胸膜增厚件胸腔积心包少量积液,右肺下叶微结节,纵隔淋巴结肿大,疗效评价为SD。
患者自2019年2月12日起至2019年8月12日共接受13个周期纳武单抗治疗,其每4个周期复查一次头颅增强MRI及胸部增强CT,疗效评价均为PR,且患者耐受良好,未出现免疫治疗相关不良反应。
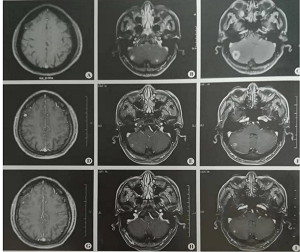
图2:A.放疗前右侧额叶未见转移灶;D.放疗后,右侧额叶可见一高信号影,为转移灶;G.2个周期纳武单抗治疗后,转移灶明显缩小;E与H对比,F与I对比,2个周期纳武单抗治疗后双侧小脑病灶均较放疗后有进一步缩小
A-C.2018年12月17日;D-F.2019年1月7日;G-1.2019年2月11日
讨论
根据《2018年全球癌症统计数据》报告将肺癌列为癌症相关发病率和致死率的首位,研究指出,晚期肺癌患者最常见死因即为远处转移,神经系统则是最常见的转移部位之一。尸检证实,64%的肺癌死亡患者存在脑转移。但值得注意的是,脑转移治疗手段仍然匮乏且低效。手术切除和全脑放疗目前分别是脑部寡转移和广泛转移的标准治疗方式。
本例患者为老年男性,有吸烟史30余年,每日20支;饮酒史30余年。高血压病史10年,最高150/90mmHg,于体检胸部CT发现双肺多处伴小结节,在全麻下行电视辅助胸腔镜下(VATS)左上肺癌根治术术后病理诊断周围型高分化腺癌,提示多组淋巴结见癌转移。根据病情分析探讨制定相应治疗措施:
2018年5月25日予以AC方案(培美曲塞860mg+卡铂540mg)化疗,7月10日予以第3个周期AC方案化疗后,化疗后出现I度骨髓抑制(血小板计数93x10°/L,血红蛋白100g/L),6月20日~2018年7月27日予以纵隔淋巴结引流区放疗(50Gy/28fx),放疗后出现放射性食管炎,8月1日予以第4个周期AC方案化疗,化疗后出现I度骨髓抑制(血红蛋白108g/L),
12月17日复查头颅增强MRI:两侧小脑结节性占位,考虑转移瘤可能,经头颅增强MRI,可见左侧及右侧小脑分别出现一高信号影,诊断为脑转移瘤,自2019年2月12日起至2019年8月12日共进行13个周期纳武单抗治疗,其每4个周期复查一次头颅增强MRI及胸部增强CT,疗效评价均为PR,且患者耐受良好,未出现免疫治疗相关不良反应。
综上:根据病灶数量、有无症状,可以给予不同的一线治疗方案。对于癫痫、瘫痪、共济失调等神经系统症状严重的,或是脑疝风险高的单发病灶,手术切除是首选治疗;对于驱动基因阳性的肺癌脑转移患者,靶向治疗能有效缓解症状、改善预后;对于脑转移病灶广泛
播散的患者,可采用全脑放疗(WBRT),而对于病灶数量≤4个的患者,立体定向放射治疗(SRS)的ORR与WBRT相当。SRS是一种立体的、定向在靶病灶区域的放疗手段,对周围正常组织损伤小,耐受性优于WBRT。但是患者在治疗后12个月内的复发率高达25%~50%。正如本案例所示,患者在接受双侧小脑病灶SRS治疗后11天,即出现右侧额叶新发病灶。另外,手术后高达60%的局部复发率和严重的放疗后神经系统不良反应,也使得传统手术及放疗敏感性和耐受性差的弱点暴露无遗。
另一方面,一线治疗失败后,可供选择的挽救治疗手段寥寥无几。研究证实,重复放疗并不能改善总生存率,而传统化疗药物的血脑屏障通过率极低,疗效不佳。以培美曲塞为例,大剂量给药(1050mg/㎡)时脑脊液药物浓度不及血药浓度的5%,中位OS仅7.3个月。因此,新的治疗方案亟待挖掘。如今,免疫治疗异军突起,对于无驱动基因突变的晚期肺癌脑转移患者,研究聚焦到已在晚期非小细胞肺癌中广泛应用的免疫检查点抑制剂-PD-L1/PD-1单抗。纳武单抗是一种人源化的PD-1单抗,作为首个被FDA批准的免疫检查点抑制剂,由于其在脑转移治疗中的疗效未知,且脑转移患者往往已接受过多线治疗,各大临床试验均将该部分患者排除在外。目前,仅有一项前瞻性非随机II期临床试验纳入了18名非小细胞肺癌脑转移患者,证实帕博丽珠单抗在脑转移患者中的ORR为33%.在本案例中,经过多学科广泛讨论,最终决定给予该患者纳武单抗进行二线治疗。
然而,目前针对肺癌脑转移患者使用免疫治疗的临床证据尚不充分,尤其缺乏来自大样本临床研究的统计数据。换个角度看,对比化疗免疫检查点抑制剂(ICI)作为晚期非小细胞肺缩二线治的疗效是公认的,但是对于脑转移患者,手术切除、WBRT和SRS才是肺癌脑转移治疗的三大基石,那么ICI在其中是一个什么样的地位?它们是否可以组合、怎么组合、会不会降低安全性?针对上面的问题,2016年Goldberg等开展了一项评价帕博丽珠单抗在黑色素瘤和非小细胞肺癌脑转移患者中疗效的单臂随机对照研究,肺癌组(18人)的ORR为33%,和既往研究中帕博丽珠单抗的全身缓解率一致。这一数据给予了在脑转移患者中使用IC1以有力支撑。基础实验证据表明,SRS能诱导免疫性细胞死亡,并提高颅内T细胞受体(TCR)的多样性,一系列回顾性临床研究也证实了同步SRS联合免疫治疗能显著提升肺癌脑转移患者的OS。虽然基础实验仍有待推进,大样本、前瞻性的临床证据也有待观察,但是联合治疗如今依旧有望成为攻坚晚期肺癌脑转移的一柄利器。
2019年Victor M.Lu等的Meta分析将SRS治疗前后4周以内采用ICI定义为同步治疗。分析结论提示同步治疗能带来1年OS的显著提高,但是1年局部无进展生存期(12-month
local progression free survival,LPFS)并无显著改善。Chen等则将SRS治疗前后2周内采用ICI定义为同步治疗,针对157名非小细胞肺癌的回顾性研究证实相较于非同步治疗,同步治疗的中位OS提升明显(24.7个月vs14.5个月)。
可见回顾性研究数据初步证实SRS与ICI的同步治疗能带来OS的改善,但是前瞻性研究依旧缺乏,并且同步治疗窗口应该如何选择,ICI药物种类对疗效和治疗窗有无影响,也仍有待更进一步的研究。
参考文献
1.Parra ER, Villalobos P, Mino B & Rodriguez-Canales J Comparison of Different Antibody Clones for Immunohistochemistry Detection of Programmed Cell Death Ligand 1 (PD-L1) on Non-Small Cell Lung Carcinoma. Appl Immunohistochem Mol Morphol 26, 83–93 (2018).
2.Gao S, et al. Neoadjuvant PD-1 inhibitor (Sintilimab) in NSCLC. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer 15, 816–826 (2020).
3.Cascone T, et al. A Phase I/II Study of Neoadjuvant Cisplatin, Docetaxel and Nintedanib for Resectable Non-Small Cell Lung Cancer. Clinical cancer research : an official journal of the American Association for Cancer Research (2020).
4. Sepesi B, et al. Nodal Immune Flare (NIF) Following Neoadjuvant Anti-PD-1 and Anti-CTLA-4 Therapy in Non-Small Cell Lung Cancer. Journal of Thoracic Oncology 14, S745–S745 (2019).
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





