FDA优先审查Daklinza—治疗HCV难治患者
Bristol-Myers Squib公司宣布,FDA已经通过了公司三项补充新药申请,审查Daklinza联合Sovaldi治疗肝硬化、移植术后以及合并感染患者的丙型肝炎病毒(HCV)感染。
新药的应用包括审查Daklinza(达卡他韦,Bristol-Myers Squib)联合Sovaldi(索菲布韦,Gilead Sciences)加或不加利巴韦林治疗失代偿期肝硬化、肝移植术后和HCV/HIV-1合并感染患者的HCV感染。根据新闻稿显示,FDA将在6个月内审查该申请,如果获批,将会给严重疾病治疗、诊断或预防的安全性或有效性提供一个显著改善的治疗方案。
“HCV不是一种一成不变的单一疾病。我们对Daklinza-索菲布韦治疗方案的关注点在于强调,即便是HCV已经取得了巨大的进步,HCV患者亚群依然需要的新的治疗选择,” Bristol-Myers Squib公司专业开发的带头人 Douglas Manion博士在新闻稿中说道。“我们期待着与FDA一起努力,以实现帮助许多难治HCV患者的最终目标。”
根据新闻稿显示,新补充的应用包括来自于ALLY-1和ALLY-2临床试验的数据。ALLY-1评估的是达卡他韦和索菲布韦每日一次联合利巴韦林连续12周的方案,用于治疗晚期肝硬化感染HCV患者或肝移植术后复发HCV患者。ALLY-2评估的是达卡他韦和索菲布韦每日一次连续12周的方案,用于治疗HCV/HIV-1合并感染患者。
临床数据显示,98%的无肝硬化初治患者和58%的有肝硬化初治患者使用达卡他韦和索菲布韦的联合治疗方案获得了持续性病毒学应答,之后,FDA在七月批准达卡他韦用于HCV基因型3 的治疗。
在先前的新闻稿中,FDA表示,在出现心律严重减慢和需要起搏器治疗的事件报道后,达卡他韦对患者和医务人员有一定的警示作用。这些事件是在胺碘酮联合索菲布韦与其他DAAs,包括达卡他韦,一起使用时发生的。
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们
联系zlzs@120.net,我们将立即进行删除处理
- 相关阅读
- · 肝硬化病因和临床表现
- · 结节性肝硬化的有效预防
- · 引起结节性肝硬化的病因
- · 结节性肝硬化有什么症状表现
- · 乙肝面前,医务人员如何做好职业防护?
热点图文
-
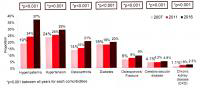
AASLD2018研究进展丨慢乙肝患者治疗期间的肾脏安全管理
在新药取得成功之前,应用口服核苷(酸)类似物(NA)治疗慢性乙型肝炎(简称...[详细]
-
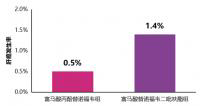
快讯丨TAF治疗4年的肝细胞癌发生率低于TDF
5月17日,在第十届全国疑难及重症肝病大会上,我国香港大学司徒伟基教授交流...[详细]