基本病史
患者,女性,53岁。母亲曾患肺癌,月经史及婚育史无特殊。2017年3月14日因“发现右乳肿块”于山东省肿瘤医院行“右乳乳腺癌保乳术(右乳乳腺肿瘤扩大切除十右侧腋下前哨淋巴结活检术十右腋下淋巴结清扫术)”。术后病理报告示:①(右乳)乳腺浸润性导管癌,Ⅱ级,肿块大小2cm×1,5cm×1.3cm,脉管内见瘤栓;送检标本示“上、下、内、外、基底、皮肤”切缘均未见肿瘤累及。②右腋下前哨淋巴结1/4枚见癌转移。③右腋下淋巴结1/18枚见癌转移。免疫组化:AR(+),BRCA1(-),CK5/6(-)、CD34(-)、D2-40(-)、ER(++70%)、E-Cadherin(+)、GCDFP-15(-),Ki-67(+)50%、Mammaglobin(+),PR(-)、P53(+),P120(+)、TOPO-II(+)、HER2(-)。术后患者接受EC-T方案化疗,前4周期为表柔比星160mg十环磷酰胺1.0g d1 q3w,5-8周期为多西他赛180mg d1q3w”。后患者于2017年11-12月接受辅助放疗:全乳50Gy,局部瘤床加量至60Gy。2017年10月至2022年10月接受他莫昔芬加卵巢功能抑制内分泌治疗。2021年10月患者无明显诱因下出现右足部响断性疼痛,患者未在意,予以理疗治疗。1年间疼痛时有加重,并出现全身多处酸痛。2022年10月PET/CT检查示:①右乳乳腺癌保乳术后改变,全身多发性骨转移:②肝S2段可疑稍低密度灶伴FDG代谢局部增高,转移瘤待排,建议MRI增强检查。
入院后诊疗经过
患者ECOG PS3分,坐轮椅入院,神清。双侧锁骨上、腋下、腹股沟未触及肿大淋巴结。身高168cm,体重58kg。疼痛评分NRS4-6分。 考虑到患者内分泌治疗后进展,且ER表达强阳性,遂采取哌柏西利加氟维司群联合治疗控制全身病灶进展。全身多处骨转移,采用双膦酸盐治疗护骨。NRS评分4-6分,予以盐酸羟考酮镇痛。约6个月后行全面复查,2023年5月31日患者上腹部MR平扫加增强检查(图1):肝内多发性转移瘤,部分较前增大;后腹膜区散在小淋巴结与前相仿。疗效评价为PD;ECOG评分2分(可拄拐行走)。患者病情较前再次进展,考虑乳腺肿瘤存在较高肿瘤异质性,遂患者至某省级中医院行肝内肿块穿刺术。术后肝脏肿块穿刺标本病理结果为:恶性肿瘤。结合临床及免疫组化结果符合乳腺浸润性导管癌转移。癌组织免疫组化染色结果:P53(5%+)、Ki-67 (30%+),ER(-)、PR(50%1+)、HER2(1+),AR(90%2+)、P120(膜+)、Hep(-)、CK19(+)、Villin(-)、PAX-8(部分+)、TTF-1(-)、CDN-2(-)、GATA-3(+)。
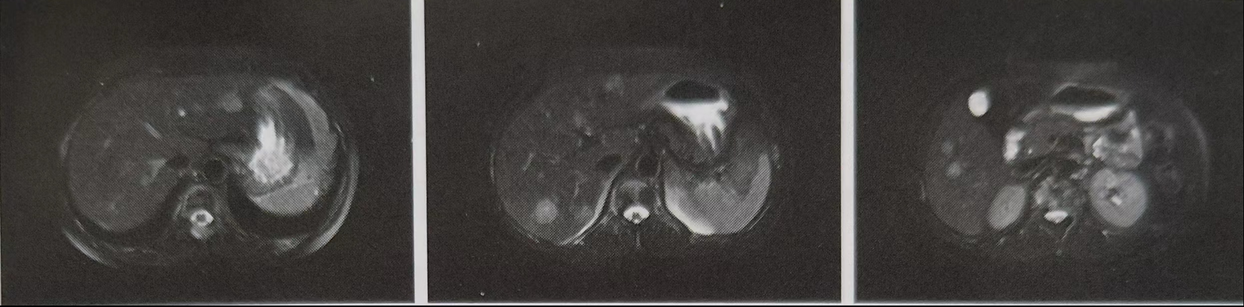
图1.2023年5月31日上腹部MR检查
患者于2023年7月2日开使接受晚期二线“白蛋白紫杉醇十卡铂方案”治疗,行卡铂化疗2分钟后,患者出现面色潮红、胸闷、气急、呼吸不畅,考虑为卡铂过敏,紧急于以地赛米松加葡萄糖酸钙等对症抗过敏处理,后症状缓解。23日改卡铂为顺铂化疗。8月11日、9月4日再次行“白蛋白紫杉醇十顺铂”化疗2疗程。化疗后患者均出现Ⅲ度白细胞减低,给予减量25%化疗。2023年9月24日上腹部MR平扫加增强,对比5月31日片(见图2):肝内多发性转移瘤,部分较前增大;后腹膜区散在小淋巴结与前相仿。2023年10月患者诉头晕、头痛,颅脑MR平扫加增强提示:左侧顶叶和右侧小脑转移性肿瘤,脑白质变性(Fazekas1级)(图3)。疗效评价为PD。
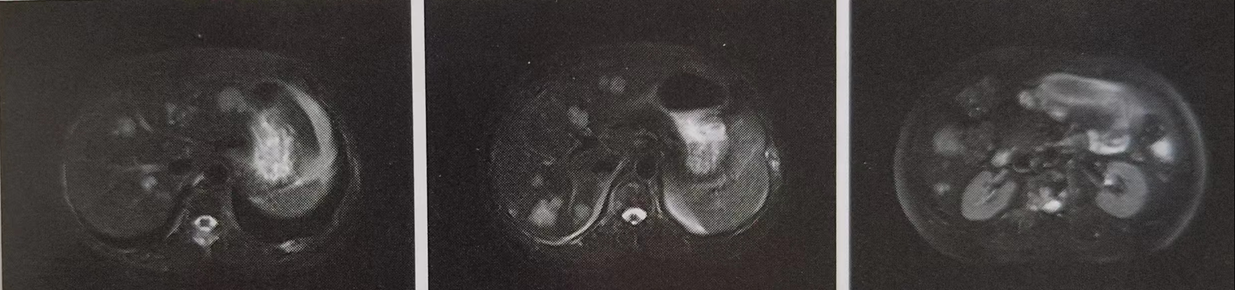
图2.2023年9月24日上腹部MR检查
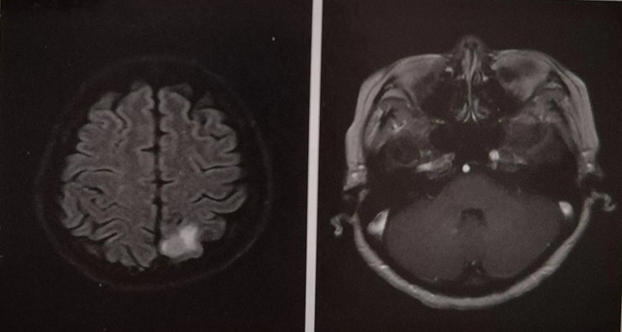
图3.颅脑MR平扫加增强影像(2023年10月)
患者于2023年10-11月接受局部放疗:全脑十局部推量,全脑95%PTV 36Gy/18次,局部肿瘤加量14Gy/7次。全身治疗:卡培他滨1.5gq12h d1-14口服,2疗程后再评估。2023年12月2日上腹部MR平扫加增强,对比9月24日片(见图4):肝内多发性转移瘤,较前增多增大:后腹膜散在小淋巴结与前相仿。病情较前再次进展,并于治疗过程中出现中重度贫(血红蛋白60-80g/L),持续升血红蛋白治疗,暂停全身化疗。
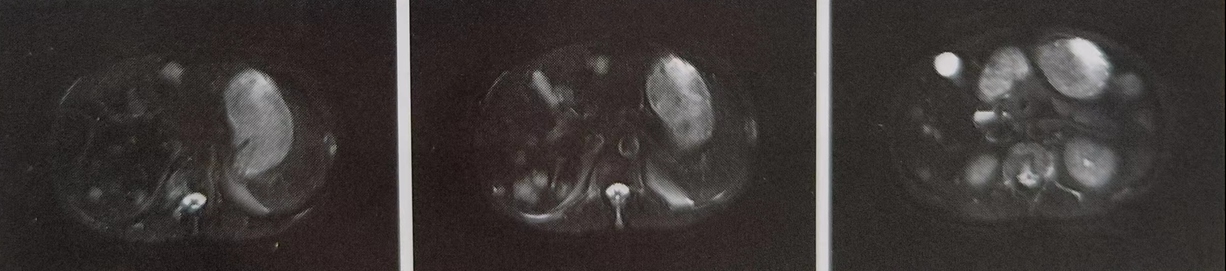
图4.2023年12月2日上腹部MR检查
2024年1月15日上腹部MR平扫加增强检查,对比2023年12月2日片(见图5):肝内多发性转移瘤较前增多,增大:后腹膜区散在小淋巴结与前相仿;左侧肾上腺占位,考虑转移。疗效评价为PD。ECOG评分4分(卧床不起)。
图5.2024年1月15日上腹部MR检查
患者此时存在中重度贫血,ECOG评分上升至4分,且前几疗程化疗并未取得满意效果。因此,患者下一步治疗需兼顾疗效和安全性,方能为患者带来新的转机。结合循证医学证据及药物特性、可及性,下一步治疗模式考虑“免疫联合抗血管生成药物”。2024年1月21日起患者接受信迪利单抗200mg静脉滴注q3w十“安罗替尼8mgd1-14口服q3w”,过程顺利。患者2024年3月30日行上腹部MR平扫加增强,对比2024年1月15日片:肝内多发性转移瘤较前缩小:左侧肾上腺占位,较前缩小。疗效评价为PR。ECOG评分2分(可拄拐行走)。患者的CEA,CA125、CA19等肿瘤标志物水平在接受信迪利单抗联合安罗替尼治疗后迅速下降,随后保持稳定。患者四线治疗的PFS尚未达到,至末次随访,患者病灶仍处于缓解状态。
临床特征归纳
(1)患者,女性,53岁。
(2)乳腺癌术后5年余,术后病理诊断(右乳)乳腺浸润性导管癌Ⅱ级,ER(++,70%)、PR(-)、HER2(-),pT1N1M0,ⅡA期;术后辅助化疗EC*4-T*4。
(3)全身骨痛1年余,肝内转移灶穿刺病理报告示:Ki-67(30%+)、ER(-)、PR(50%1+)、HER2(1+)。
(4)全身骨痛,初始NRS4-6分。
(5)先后经历一线强化内分泌治疗(哌柏西利联合氟维司群)、二线(白蛋白紫杉醇联合顺铂)、三线(卡培他滨)化疗,肝转移灶并未明显退缩,反而不断进展。
(6)四线治疗:信迪利单抗联合安罗替尼,肝内肿块明显控制。
讨论
本病例首诊时为一例LuminalB型(HER2阴性)早期乳腺癌,在接受根治性手术、辅助放化疗及5年辅助内分泌的标准治疗后,随即出现复发转移,肝转移灶分子病理转变为类似于三阴性的类型。患者经历了一线强化内分泌治疗(哌柏西利联合氟维司群),二线(白蛋白紫杉醇联合顺铂),三线(卡培他滨)化疗后,肝转移灶并未明显退缩,反而不断进展。考虑到患者体力状况不佳,且存在中重度贫血,下一步需选择一种疗效与安全性并重的治疗方案。
抗血管生成药物在乳腺癌中应用
血管生成在肿瘤生长及侵袭过程中扮演了重要角色。已有研究表明,抗血管生成药物贝伐珠单抗单用或联合化疗药物,对转移性乳腺癌有一定疗效[1];其他小分子酪氨酸激酶抑制剂(TKI,如索拉非尼,舒尼替尼等,也在乳腺癌领域进打了探索。然而索拉非尼单独使用并不能改善乳腺整患者的PFS,而舒尼替尼的不良反应限制了其在乳腺癌中的应用[2-4]。一项探讨安罗替尼对接受过化疗及内分泌治疗的HR阳性/HER2阴性或发生转移的三阴性乳腺癌患者的有效性及安全性研究显示:三阴性乳腺癌患者队列ORR10.0%(95%CI:0.25-44.50),疾病控制率(DCR)为70.0%(95%C1:34.75-93.33)[5]。因此,安罗替尼对既往经过治疗的转移性HER2阴性乳腺癌患者表现出客观疗效,毒性可耐受。
抗血管生成药物联合免疫治疗协同增效
同时,三阴性乳腺癌相比其他亚型乳腺癌周围浸润淋巴细胞比较丰富,为ICI的应用提供了免疫微环境基础;且肿瘤突变负荷相对比较大,为机体免疫细胞的识别提供抗原基础;三阴性乳腺癌PD-L1表达比较高,为ICI的应用提供了很好的靶点基础。而这两种药物的联合模式在三阴性乳腺癌动物模型基础研究及临床研究中均展示出了抗血管生成药物能够增强PD-1抑制剂抑制肿瘤的作用并提高其敏感性,在连续给药组的患者中,ORR为43.3%,DCR为63.3%,中位PFS达到3.7个月。
总结
因此,抗血管生成药物联合免疫治疗已经在三阴性乳腺癌的治疗中展现了应用前景,该治疗模式也在NSCLC、结直肠癌、肝癌、宫颈癌等瘤种的治疗中展现出了临床获益和应用价值。依据循证医学证据及患者充分知情后,该患者应用了安罗春尼联合信迪利单抗的治疗方案,治疗后肝转移灶。左侧肾上踪占位均软前显者缩小,疗效评价达P取,且体力状态显著改善,一举扭转了多次化疗无效的治疗“颓势”,为患者重新迎来了生命的曙光。
参考文献
[1]MILIER K.WANG M.GRALOW J.et al.Paclitaxel plusbevacizumab versus paclitaxel alone for metastatic breast cancer NEngl J Med,2007,357(26):2666-2676.
[2]MORENO ASPITIA A,MORTON R F.HILLMAN D W.et al.Phasel trial of sorafenib in patients with metastatic breast cancerpreviousy exposedto anthracyclines taxanes:North Central Cancer Treatment Group and Mayo Clinic Trial N0336 JClin Oncol,2009,27(1):11-15.[3]BURSTEIN HJ,ELIAS A D,RUGO H S,et al.Phase Il study ofsunitinib malate,an oral multitargeted tyrosine kinase inhibitor,inpatients with metastatic breast cancer previously treated with ananthracycline and a taxane [J].J Clin Oncol,2008,26(11):1810-1816.[4]HU X,ZHANG J,XU B,et al.Multicenter phase lI study ofapatinib,a novel VEGFR inhibitor in heavily pretreated patients withmetastatic triple-negative breast cancer [J].Int J Cancer,2014,135(8):1961-1969.[5]HU N,SI Y,YUE J,et al.Anlotinib has good efficacy and lowtoxicity:a phase II study of anlotinib in pre-treated HER-2 negativemetastatic breast cancer [J]Cancer biol med,2021,18(3):849-859.[6]LIU J,LIU Q,LI Y,et al.Efficacy and safety of camrelizumabcombined with apatinib in advanced triple-negative breast cancer:anopen-label phase II trial J].J Immunother Cancer,22020,8(1):e000696.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





