一、引言
前列腺癌,一种在男性中普遍存在的恶性肿瘤,随着医学检测技术的进步,其诊断率持续上升。传统的治疗方法,如根治性前列腺切除术(RP)或放疗,虽然在某些情况下能够提供治愈的可能,但也带来了不可忽视的风险和生活质量的显著下降。在这样的背景下,积极监测成为了一种可行的替代方案,尤其是对于那些中度风险的前列腺癌患者。然而,要准确判断哪些患者适合积极监测,需要更为精准的风险评估模型。
本文旨在解读最近的一项创新研究[1],通过结合术前临床参数和磁共振成像(MRI)结果构建的MAP模型,并探讨其在前列腺癌个体化治疗中的应用。这项研究不仅开辟了利用综合数据提高治疗决策准确性的新途径,还可能改变我们对前列腺癌治疗策略的整体认知。
二、 研究背景
随着科学研究的深入,医学界对前列腺癌的理解不断增加,尤其是在疾病管理方面。然而,对于患有中度风险前列腺癌的患者来说,治疗路径选择仍然具有挑战性。积极监测作为一种治疗策略,旨在减少不必要的治疗干预,同时密切监控疾病进展,以便在必要时及时介入。这种策略的有效实施,依赖于准确评估患者出现不良病理结果的风险,即那些可能会在根治性前列腺切除术(RP)中发现的高级别癌症或其他危险特征。
三、研究概述
这项研究的设计和开展包含了几个关键步骤,以确保其能够有效地达到研究目的。以下是其主要步骤:
1、目标人群的选择:研究对象是1284名在2013年至2019年间接受根治性前列腺切除术(RP)治疗的低至中等风险前列腺癌患者。
2、数据收集与分析:
-收集了患者的术前临床参数,如年龄、前列腺特异性抗原(PSA)水平、活检的Gleason分级组等。
-MRI发现也被纳入,包括前列腺体积、前列腺成像报告和数据系统(PI-RADS)评分,以及是否有MRI可见的前列腺外扩展(MRI-EPE)。
3、统计方法的应用:
-使用逻辑回归分析来确定哪些因素与不良病理结果显著相关。不良病理定义为RP时的非器官限制性疾病、淋巴结侵犯或病理分级组3以上。
-基于这些因素,开发了一个新的诺莫图,用于评估中度风险前列腺癌患者进行积极监测的适宜性。
4、模型的验证:
-对比了新开发的诺莫图与现有的Gandaglia风险计算器(Gandaglia-RC)在预测不良病理结果方面的有效性。
-通过曲线下面积(AUC)来评估模型的预测能力。
5、结果的解读:
-分析了使用这个新的诺莫图选择积极监测患者的可能性,与使用传统方法相比,新模型是否能更准确地选择适合积极监测的患者。
-对模型进行了外部验证,确保其在不同的人群中的适用性。
通过以上步骤,这项研究成功地开发并验证了一个新的工具,能够更准确地评估中度风险前列腺癌患者是否适合进行积极监测。这不仅提高了治疗的个体化程度,也可能减少不必要的治疗和相关副作用,从而提升患者的生活质量。
四、研究结果的深入解读与分析
1、1284例中危前列腺癌患者接受根治性前列腺切除术(RP)的最终病理结果
图1表格总结了1284名接受根治性前列腺切除术(RP)的中度风险前列腺癌患者的最终病理结果。以下是对表格内容的解读分析:
-RP GGG(Gleason grade group):该列显示了患者术后Gleason评分的分布。Gleason评分是一种评估前列腺癌严重程度的标准,数值越高表示癌症越严重。
·GGG1(18%):这一组患者的病情相对较轻。
·GGG2(72%):这是最大的一组,表明大多数患者属于中度风险组。
·GGG3-5(10.7%):这些患者的癌症较为严重。
-pT stage:该列显示了患者术后肿瘤分期,这是根据肿瘤在前列腺和周围组织中的扩散程度来评定的。
·pT2(85%):表示肿瘤局限在前列腺内。
·pT3a和pT3b(14.8%):表示肿瘤开始扩散至前列腺外的组织。
-pN stage:该列显示了术后淋巴结的病理分期。
·pN0-X(98%):表示没有淋巴结转移。
·pN1(2%):表示发现了淋巴结转移。
综上所述,在有利病理结果的患者中(76.9%),大部分患者属于GGG1和GGG2,且所有这些患者均未出现pT3b阶段的肿瘤或淋巴结转移。在不良病理结果的患者中(23.1%),大部分患者有较高的GGG分数,大多数属于pT3阶段,并且有较高比例的淋巴结转移。这强调了RP GGG和pT stage在预测病理结果上的重要性。这些信息对于理解前列腺癌的临床特征和预后至关重要。
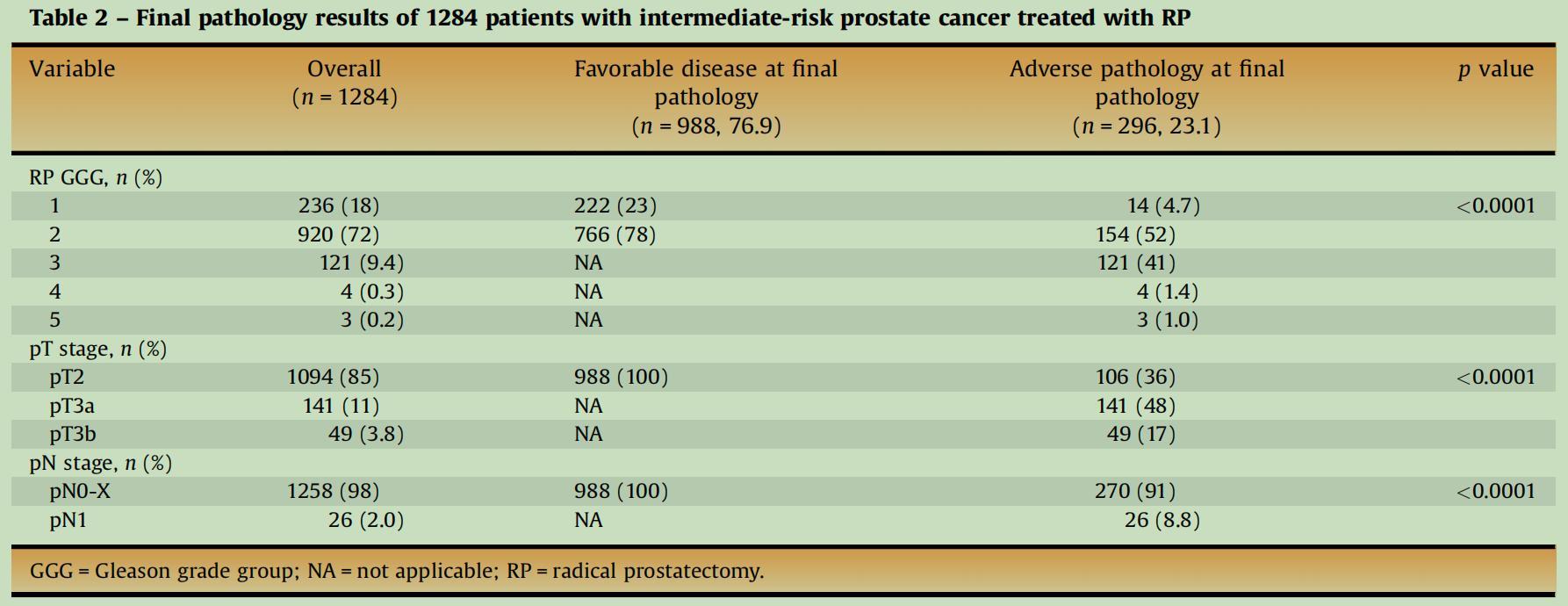
图1
2、根治性前列腺切除术(RP)后出现不良病理结果的危险因素
图2表格具体展示了单变量分析和多变量分析预测在根治性前列腺切除术(RP)中出现不良病理结果的危险因素。表格中的数据包括了危险因素的名称、比值比(OR)、95%置信区间(CI)和p值。以下是对表格内容的详细解读:
-年龄:在单变量分析中,每增加一年,不良病理的风险增加3%,在多变量分析中增加4%,这在统计上是显著的(p < 0.001)。
-种族:非裔美国人与参考组相比,在单变量分析中没有显著差异,但在多变量分析中未给出数据。
-PSA:每单位PSA增加,不良病理的风险在单变量分析中增加11%(p < 0.001),在多变量分析中增加13%(p < 0.001),这在统计上是显著的。
-PSA密度:每0.1单位增加,不良病理的风险在单变量分析中增加20%(p < 0.001),在多变量分析中未给出数据。
-cT阶段:cT2a与参考组cT1c相比,在单变量分析中风险增加了37%(p=0.031),在多变量分析中未给出数据。
-GGG活检:Gleason分数组2在单变量分析中比参考组(Gleason分数组1)风险高出129%(p < 0.001),在多变量分析中风险高出95%(p < 0.001)。
-阳性活检芯数:在单变量分析中每增加一个阳性活检芯,不良病理的风险增加4%(p=0.07),在多变量分析中未给出数据。
-阳性活检芯百分比:在单变量分析中,随着阳性活检芯占比增加,不良病理的风险轻微增加(p=0.002),在多变量分析中未给出数据。
-NCCN风险:与NCCN低风险相比,有利病理的风险在单变量分析中增加了117%(p < 0.001),在不利病理中增加了490%(p < 0.001),在多变量分析中未给出数据。
-靶向活检:进行靶向活检的患者在单变量分析中风险降低了29%(p=0.029),在多变量分析中风险降低了41%(p =0.001)。
-MRI前列腺体积:在单变量分析中,每增加一单位体积,不良病理的风险降低了1%(p=0.01),在多变量分析中风险降低了2%(p<0.001)。
-PIRADS评分:与1-2分相比,PIRADS评分为5的患者在单变量分析中风险增加了121%(p<0.001),在多变量分析中未给出数据。
-MRI-EPE:存在EPE的患者在单变量分析中风险增加了106%(p<0.001),在多变量分析中增加了75%(p<0.001)。
综上所述,在对前列腺癌进行根治性切除术(RP)的决策过程中,准确地评估不良病理结果的风险是至关重要的。图2中展示的数据通过单变量和多变量分析,精细地描绘了影响这一结果的多种因素。这些详尽的统计数据不仅证实了已知的风险因素,而且还为包括MRI特征在内的新的预测因子提供了科学依据。这些发现提供了强有力的证据,支持在前列腺癌治疗计划中使用综合临床和影像学参数的决策模型。
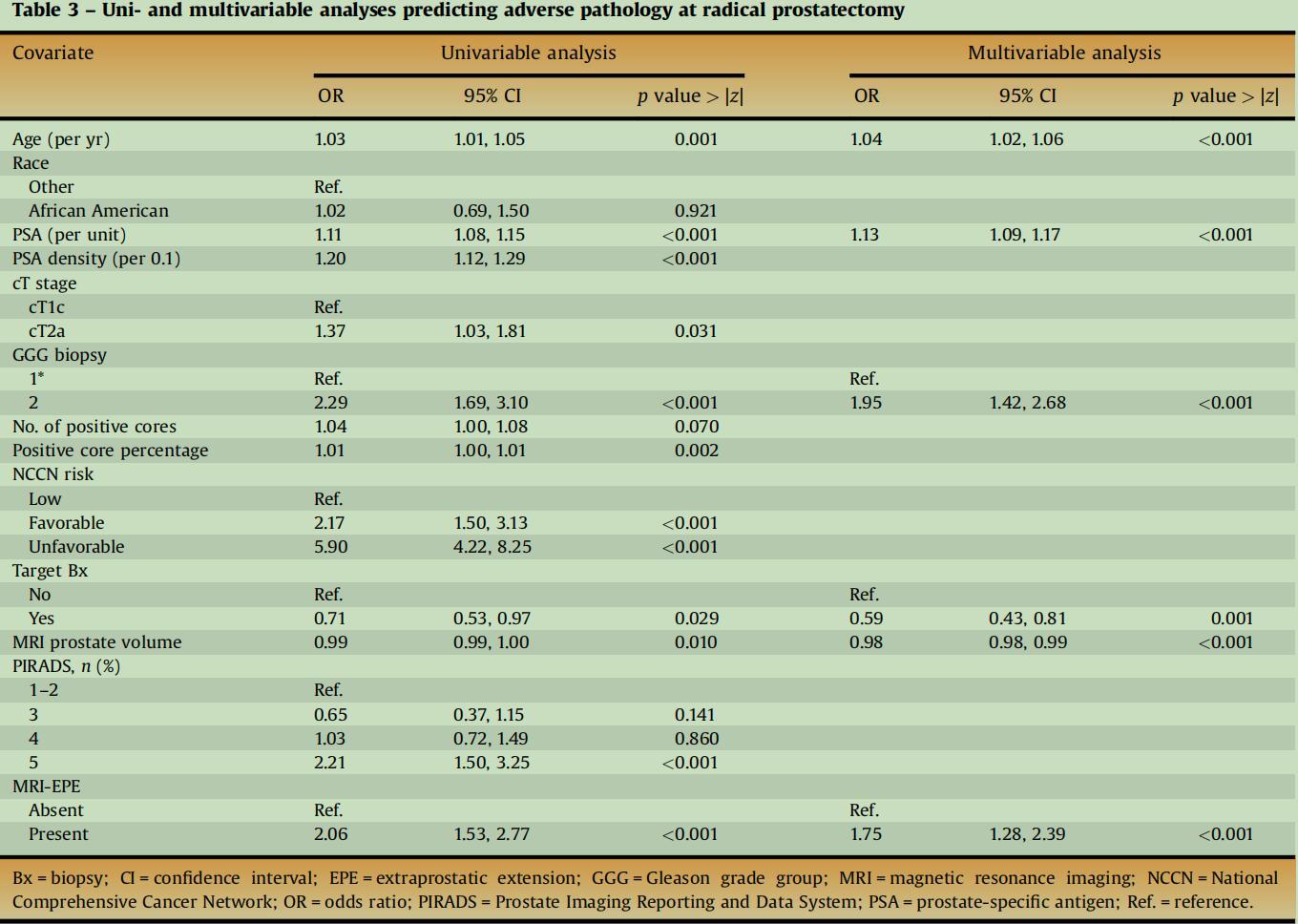
图2
3、MAP预测模型的构建
图3显示了MAP预测模型的构成。最终的多变量模型中包括的因素有:
-手术时的年龄
-PSA值
-活检格里森分级组(Bx-GGG)
-活检技术(目标活检与标准活检)
-MRI测量的前列腺体积
-MRI显示的前列腺外扩展(MRI-EPE)
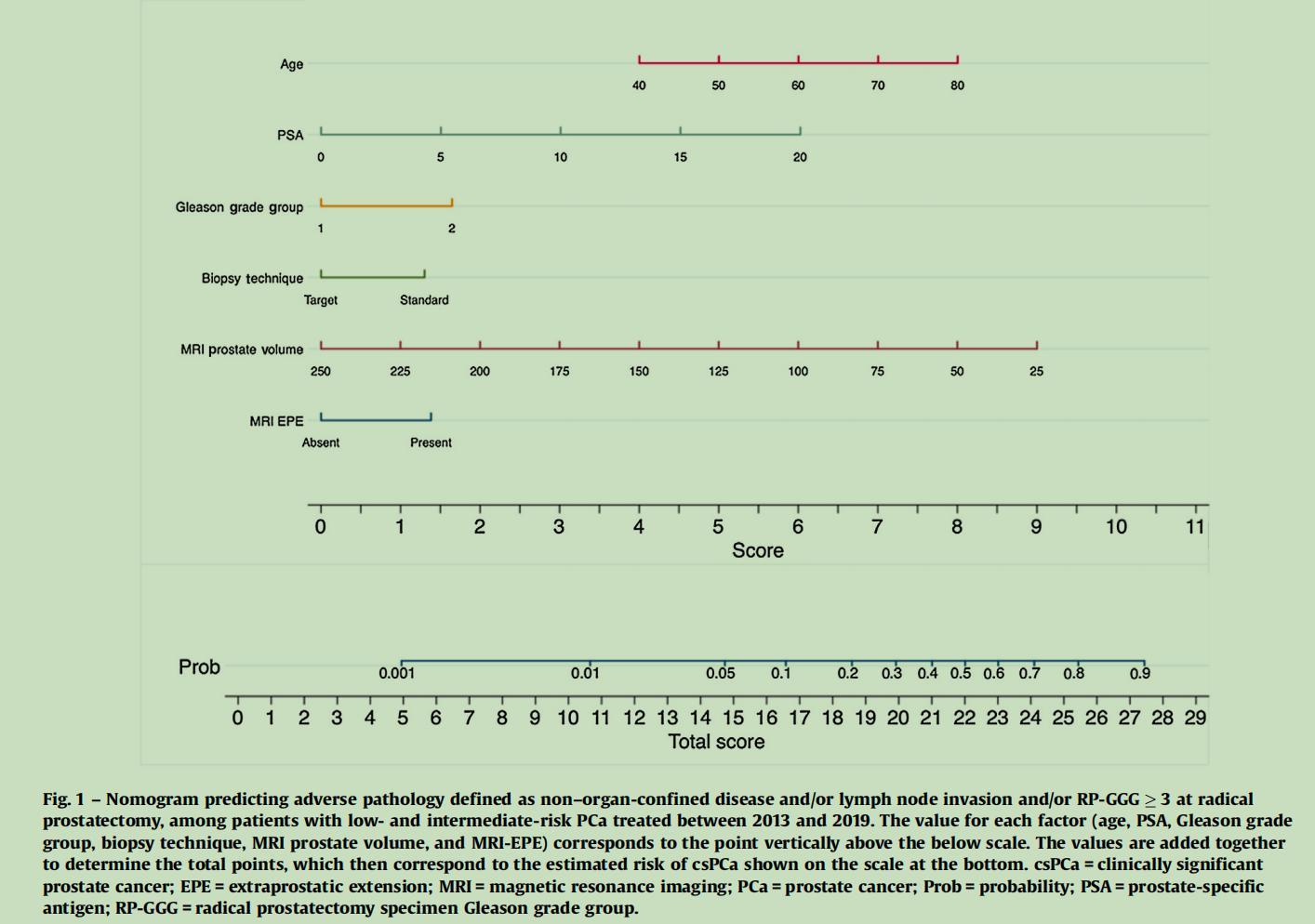
图3
4、不同预测模型之间的优劣
图4展示了在前列腺癌治疗决策中用于预测不良病理结果的不同模型的效果。以下是对各图的解读分析:
(1)图4A- ROC曲线
ROC曲线比较了不同模型预测不良病理结果的能力。在这里,AUC衡量了模型的预测准确性;AUC越接近1,预测能力越好。
-MAP模型:AUC为0.71,表明其预测不良病理的能力较好。
-Gandaglia-RC:AUC为0.63,低于MAP模型,表明其预测能力较弱。
-PRIAS:AUC为0.54,预测能力最弱。
-NCCN LR/FIR:AUC值在0.58和0.59之间,预测能力处于中等水平。
(2)图4B-决策曲线分析(DCA)
决策曲线分析展示了不同概率阈值下各个模型的净收益。净收益是指在特定阈值下,通过使用模型预测而得到的真正益处(例如,正确预测不良病理)与因错误预测产生的代价(例如,不必要的治疗)之间的差值。
-MAP模型和Gandaglia-RC的曲线显示在大部分概率阈值下它们提供正净收益,但MAP模型在更多的阈值范围内提供更高的净收益。
-PRIAS和NCCN LR的曲线在大部分阈值下净收益较低。
(3)图4C-校准图
校准图比较了预测概率与实际发生概率的一致性。理想情况下,模型的预测概率应当紧贴45度线(表示完美预测)。
-MAP模型的曲线在逻辑回归和留一法交叉验证(LOOCV)后显示了良好的校准性,尤其是在预测概率低于约0.6时。
总体而言,MAP模型在预测前列腺癌的不良病理结果方面,相较于其他模型展现出更好的效果。它在ROC曲线上有更高的AUC值,在决策曲线分析中提供了更高的净收益,在校准图中显示了较好的一致性。这些结果表明,MAP模型可能是一个更可靠的工具,用于在根治性前列腺切除术(RP)中预测不良病理结果,从而可能帮助临床医生在治疗计划选择上做出更精确的决策。
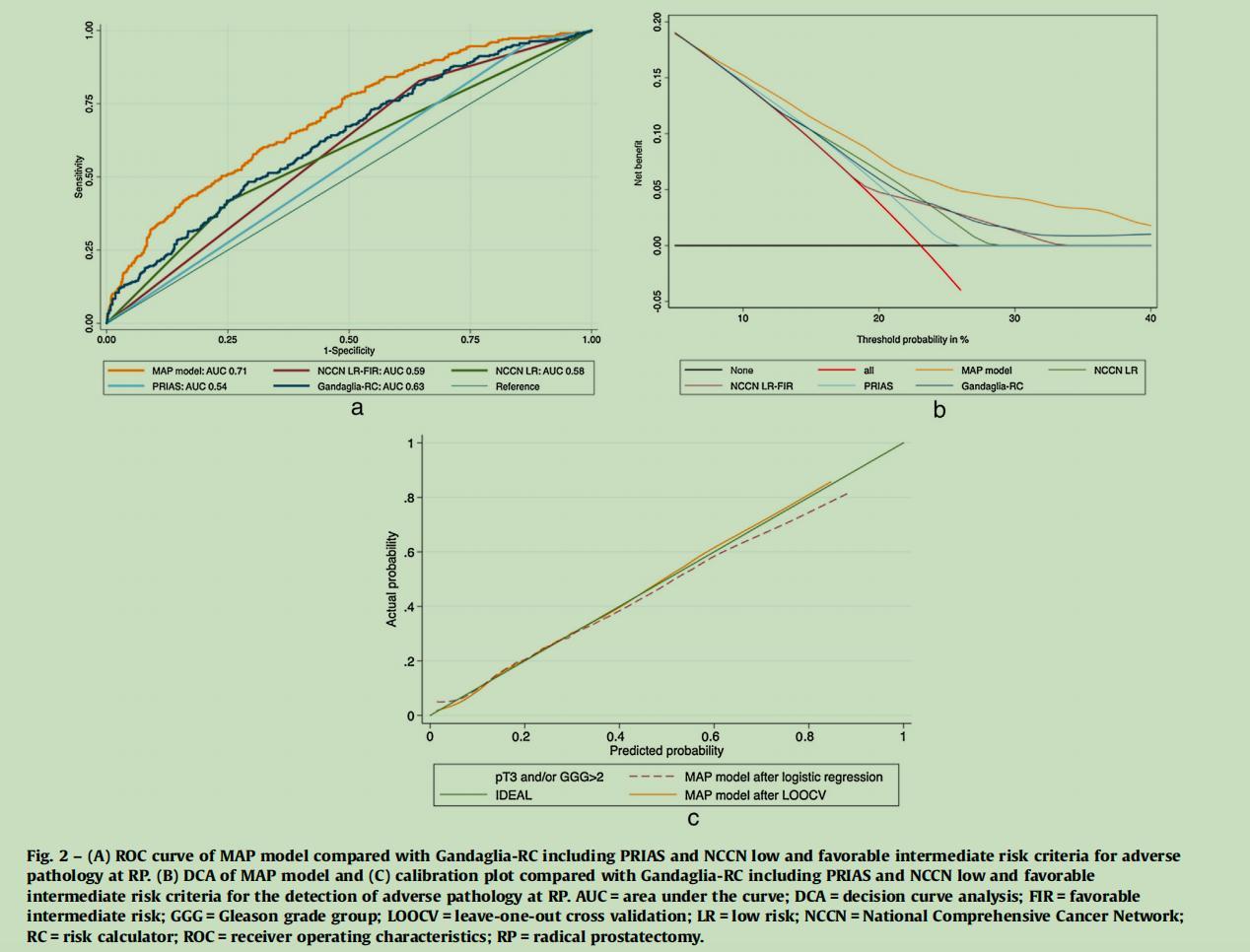
图4
五、MAP预测模型的临床应用价值
在现代医疗实践中,个体化治疗方案的制定已成为优化患者治疗结果的关键。MAP模型作为这一理念的具体体现,通过精细化的风险评估,推动了前列腺癌治疗决策的革新。该模型不仅考虑了常规的临床参数,如年龄和PSA水平,而且还纳入了前列腺磁共振成像的结果,如MRI测量的前列腺体积和MRI-EPE,这些参数对于揭示肿瘤的性质和行为至关重要。
Gleason评分,作为评估肿瘤分化程度的标准,长久以来被用来预测前列腺癌的侵袭性和治疗响应。MAP模型通过结合Gleason评分与MRI的定量分析,提供了一个全面的肿瘤特征描述,使得医生能够更加精确地判断肿瘤的潜在风险。
此外,EPE的存在是判断肿瘤侵袭性的另一个关键指标。通过MRI可视化这一特征,MAP模型增加了对肿瘤行为的直观了解,这在选择适合的治疗策略时是不可或缺的。当EPE呈阳性时,通常意味着肿瘤具有更高的侵袭性,这可能促使医生推荐更积极的治疗方法,而非积极监测。
MAP模型的一个显著优势在于其预测准确性的提高。如同ROC曲线所展示的那样,该模型的AUC值显著高于其他传统方法,这表明它在区分需要积极治疗与适合积极监测的患者方面更为可靠。在实际临床应用中,这种准确性的提高意味着患者可以获得更符合其病情的治疗建议,从而可能避免不必要的侵入性治疗及其相关的并发症。
六、结论
在探索前列腺癌治疗决策的新领域中,MAP模型代表了一种重要的进步。通过综合考虑临床参数和先进的MRI技术,该模型提供了一个更全面、更精确的方法来评估患者的病理风险。尽管MAP模型在前列腺癌治疗决策中展示了显著的潜力,但对其有效性和普适性的理解仍需进一步深入。首先,考虑到研究的回顾性性质,其结果可能受到数据选择和记录偏差的影响。此外,研究样本可能不足以代表所有人群,特别是在不同种族、年龄或有不同健康状况的患者中。
在今后的研究和实践中,对这一模型的细化和完善将是重要的工作重点。包括前瞻性研究、模型的不断更新以适应新的医学发现,以及探索在不同临床环境中有效实施该模型的策略。正如我们在临床案例中所见,MAP模型有助于避免过度治疗和提高治疗决策的准确性,对患者的生活质量和治疗结果都有着积极的影响。
总之,MAP模型的开发和应用是向更精确、更个性化的医疗治疗迈出的一大步。随着医学技术的不断进步和数据驱动决策在临床实践中的日益普及,我们期待这种模型能够进一步优化,为前列腺癌患者提供更优质、更个性化的治疗选择。
参考文献:
[1]Lantz A, Falagario UG, Ratnani P, Jambor I, Dovey Z, Martini A, Lewis S, Lundon D, Nair S, Phillip D, Haines K, Cormio L, Carrieri G, Kryprianou N, Tewari A. Expanding Active Surveillance Inclusion Criteria: A Novel Nomogram Including Preoperative Clinical Parameters and Magnetic Resonance Imaging Findings. Eur Urol Oncol. 2022 Apr;5(2):187-194. doi: 10.1016/j.euo.2020.08.001. Epub 2020 Sep 3. PMID: 32891599.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。