黏附蛋白(cohesin)是一种由SMC1、SMC3、STAG1/2和RAD21四个核心亚基构成的蛋白质复合物。它们与细胞表面黏附分子一起共同形成了一层致密膜包裹住细胞膜上各种生物活性物质,并通过这些膜蛋白来完成一系列复杂而精细的生理生化活动。在细胞分裂的过程中,它扮演着至关重要的角色,参与染色体结构的维持、有丝分裂的准备以及染色体的分离等关键步骤。
在有丝分裂的早期阶段,黏附蛋白会紧密地将染色体上的姐妹染色单体连接在一起,从而形成了染色体联会的复杂结构。当一个染色体发生断裂后,其配对片段又可重新结合成另一完整的新个体。确保有丝分裂过程中每个染色体的正确复制和分离,以确保遗传信息的精准传递,从而保障遗传信息的完整性。同时,它也是调控细胞周期进行以及细胞分化发育的重要机制之一。此外,黏附蛋白在多个生物学过程中扮演着重要角色,包括但不限于DNA损伤修复、基因表达和基因组拓扑结构的维护等。
然而,研究人员在美国国家癌症研究所(National Cancer Institute,NCI)的探索中发现了一种蛋白质复合物的另一项重要功能,该功能为数十年来癌症研究人员所面临的一些难题提供了解决方案。
Science Advances发表的一项研究“Cohesin regulates alternative splicing”表示,黏附蛋白对选择性剪接具有调节作用。研究的作者之一、NCI的免疫学家Dinah Singer表示:“在急性骨髓性白血病(AML)的原发患者细胞中,存在黏附蛋白突变,从而导致剪接发生改变。”这种变化与肿瘤相关基因表达密切相关。研究表明,在某些情形下,异常的选择性剪接调控可能会引发癌症的发生和进展。黏附蛋白在AML和其他类型的癌症的进展中也扮演了一定的角色,这一事实暗示着其在癌症的发展中具有重要作用。此外,还发现一些药物能诱导肿瘤组织产生一种与正常组织细胞不同的黏连状态。
当基因的编码区出现不同的组合方式时,在不同的细胞类型或发育阶段中,会出现一种选择性的剪接现象,这种现象可以编码多种不同的蛋白质。选择性剪接是一种普遍存在于真核生物基因组序列之中的保守性调控机制。在细胞发育和死亡等多种过程中,选择性剪接扮演着至关重要的角色。高达95%编码蛋白基因具有选择性剪接作用。这种选择可以导致许多不同类型的基因功能改变,如转录激活和蛋白质翻译后修饰等。当基因突变发生时,核苷酸在剪接位点上的位置会发生插入或删除的变化。这种现象在人类和哺乳动物都有发现。这些剪接突变与AML中的一系列基因变异密切相关,其中有20%的病例呈现出了凝聚素突变的特征。凝胶电泳和免疫荧光检测证实了这种聚集素突变导致黏连现象的产生。因此,研究人员正在探究黏附蛋白的突变是否与选择性剪接存在关联。
在此项研究中,Dinah和她的研究团队通过诱导RAD21核心成分的分解,以消耗HCT116细胞中的黏附蛋白。他们将该技术用于分析那些具有高表达黏附蛋白的小鼠肿瘤组织中的剪接情况。在对黏附蛋白耗尽的细胞系进行RNA测序研究时,研究人员发现,各种形式的选择性剪接都受到了明显的影响,与对照组相比。
研究人员对HCT116细胞在黏附蛋白耗尽或未耗尽的情况下的转录率进行了比较,结果表明黏附蛋白并非通过影响转录来间接影响剪接过程。因此,他们认为黏附蛋白对转录的抑制作用是导致基因表达量下降的主要原因之一。先前的研究表明,溴结构域蛋白BRD4和黏附蛋白在整个细胞周期中都扮演着重要的角色,此外,BRD4还有助于调控细胞内和体内的选择性剪接。那么,BRD4和黏附蛋白之间是否存在协同作用,以调整剪接过程。
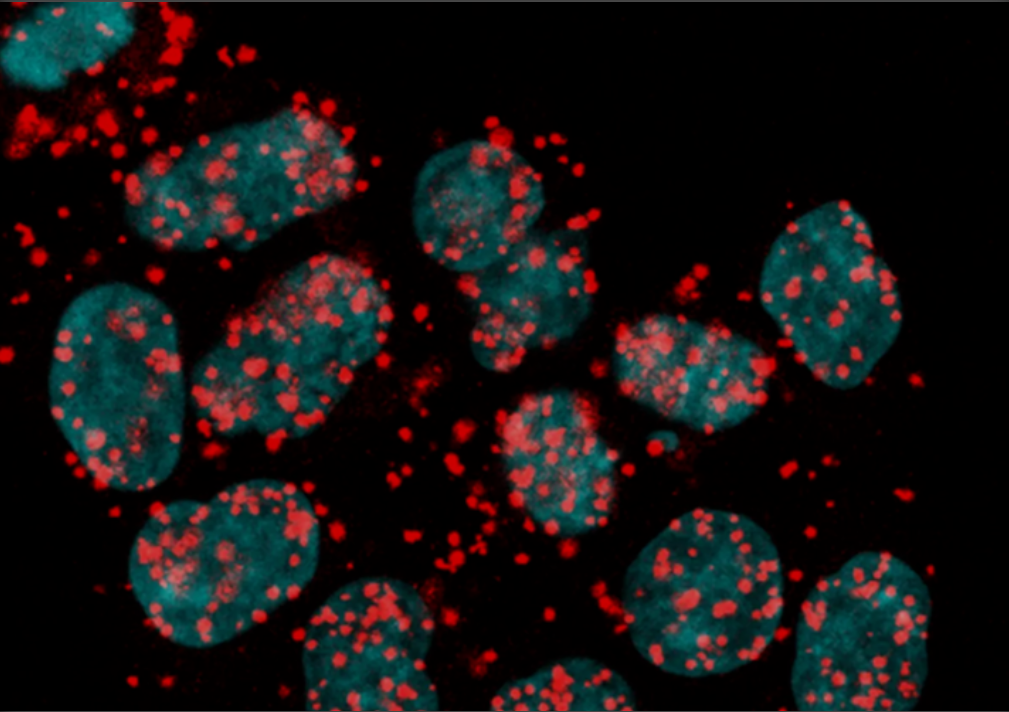
图:正常条件下黏连蛋白亚基RAD21和剪接因子U1-70的显微镜图像
研究人员发现,细胞中的BRD4和黏附蛋白在单独或同时耗尽时,其剪接模式表现出不同的特征,即BRD4和黏附蛋白各自对一部分剪接进行调节,而对另一部分剪接进行共同调节。这可能是导致在小鼠体内发生不同程度黏连现象的原因之一PLAs和免疫共沉淀的结果及重组黏附蛋白与BRD4的结合能力测试说明,BRD4与黏附蛋白之间存在着直接的相互作用,这种相互作用是由PLAs和免疫共沉淀检测结果所证实的。
在研究AML中黏附蛋白的作用时,研究人员使用了一组独立的、公开可用的患者样本RNA测序数据集。在三组数据的分析中,第一组患者的黏附蛋白发生了突变,但剪接因子并未发生突变;第二组患者的剪接因子也发生了突变,但黏附蛋白没有发生突变;而第三组对照组的黏附蛋白和剪接因子均没有发生任何突变。此外,我们也比较了不同性别的受试者之间是否存在差异性。如果黏附蛋白的突变不是影响选择性剪接的一个因素,那么第一组和第三组的剪接方式应该是相同的。本研究对不同组织来源的黏连基因进行鉴定并将其应用于临床诊断及治疗药物筛选中,为进一步开发新药提供参考。研究发现,在样本中存在黏附蛋白突变的情况下,出现了一种独特的剪切模式。为了进一步验证黏附蛋白突变对选择性剪接的直接影响,研究人员对两个经过单点突变改造的小鼠胚胎干细胞克隆进行了分析,结果表明剪接模式发生了改变,同时与剪接因子的相互作用减少,从而证实了因果关系。
这项发现为研究黏附蛋白在癌症发生和发展中的作用提供了更为深入的探索空间,为科学家们带来了新的可能性。研究人员已经确定一种黏连分子与肿瘤细胞表面的受体结合后能够激活免疫系统对癌细胞进行攻击。黏附蛋白是一种有效的治疗AML和其他类型癌症的方法,这意味着我们可以采用特定的策略来应对这一挑战。然而,此项研究仍受制于若干限制条件。尽管AML患者样本数量有限,科学家们仍需深入研究以验证这些发现是否普遍存在于其他癌症类型之中。此外,黏附蛋白的具体机制尚未被深入研究,因此需要进一步探索相关领域的研究。
总体而言,这项研究为我们提供了一种全新的视角,以便更好地理解癌症的发生和进展。黏附蛋白在细胞中发挥着重要作用,它不仅能够促进肿瘤血管生成,还能调节癌细胞增殖和分化以及维持正常组织结构等多种生物学过程。通过探索黏附蛋白的另一种作用,科学家们得以深入研究与癌症相关的问题,并探索新的治疗方案。
参考文献:
[1] Singh AK, Chen Q, Nguyen C, et al. Cohesin regulates alternative splicing. Sci Adv. 2023 Mar;9(9):eade3876. doi: 10.1126/sciadv.ade3876.
[2] [2]https://www.the-scientist.com/news-opinion/mutated-cohesin-throws-dna-splicing-out-of-whack-resulting-in-cancer-70998
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





